
| A. | 氯气可用于自来水的消毒 | |
| B. | 四氧化三铁常用作红色油漆和涂料 | |
| C. | 明矾可用于净水 | |
| D. | 过氧化钠用于呼吸面具和潜水艇里氧气的来源 |
分析 A.氯气与水反应生成次氯酸,次氯酸具有强的氧化性,能够杀菌消毒;
B.四氧化三铁为黑色,三氧化二铁为红棕色;
C.明矾电离产生的铝离子水解生成具有吸附性的氢氧化铝胶体;
D.过氧化钠与水、二氧化碳反应都生成氧气,常用于做供氧剂.
解答 解:A.氯气与水反应生成次氯酸,次氯酸具有强的氧化性,能够杀菌消毒,可以用于自来水消毒,故A正确;
B.三氧化二铁为红棕色固体,常用作红色油漆和涂料,故B错误;
C.明矾电离产生的铝离子水解生成具有吸附性的氢氧化铝胶体,能够吸附水中的固体杂质颗粒,可以净水,故C正确;
D.过氧化钠与水、二氧化碳反应都生成氧气,常用于做供氧剂,可以用于呼吸面具和潜水艇里氧气的来源,故D正确;
故选:B.
点评 本题考查了元素化合物知识,侧重考查物质的用途,明确物质的性质是解题关键,题目难度不大,试题侧重于化学与生活、生产的联系的考查,有利于培养学生的良好科学素养和学习的积极性,注意对相关知识的积累.


科目:高中化学 来源: 题型:多选题
| A. | 用粗盐代替NaCl固体 | |
| B. | 定容时,溶液液面低于容量瓶刻度线 | |
| C. | 从烧杯向容量瓶转移溶液时,有少量溶液溅出 | |
| D. | 向容量瓶转移溶液时,容量瓶中有少量蒸馏水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙烯(CH2=CHCH3)易发生加成反应,一定条件下也可能发生取代反应 | |
| B. | 若有机物甲和乙是同分异构体,则甲和乙的化学性质相似 | |
| C. | 某有机物燃烧只生成物质的量之比为l:2 的CO2和H2O,说明其最简式为CH4 | |
| D. | 分子式分别为C2H6O、C3H8O的有机物一定互为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应中电能转化为化学能 | |
| B. | 反应低温可以自发转化 | |
| C. | 上述反应若使用催化剂,能改变反应的△H | |
| D. | 反应CH4(g)=C(s)+2H2(g)的△H=74.8kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 称取7.68gCuSO4加水配成480mL溶液 | |
| B. | 称取12.5g 胆矾,加水配成500mL溶液 | |
| C. | 称取8.0CuSO4,加水500mL 溶解配成溶液 | |
| D. | 称取12.0g胆矾,加水480mL溶解配成溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | lmol Cl2与足量的铁充分反应,.转移的电子数为2NA | |
| B. | 标准状况下,11.2L水所含分子数为0.5NA | |
| C. | 常温常压下,22.4L氖气含有NA个氖原子 | |
| D. | 124g Na2O溶于水后所得溶液中含有O2-离子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
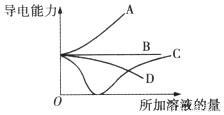
| A. | 曲线A表示NaOH溶液中滴加稀盐酸 | |
| B. | 曲线B表示CH3COOH溶液中滴加KOH溶液 | |
| C. | 曲线C表示Ba(OH)2溶液中滴加稀硫酸 | |
| D. | 曲线D表示Cu(OH)2悬浊液中滴加HNO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com