
【题目】下列元素中金属性最强的是
A.LiB.MgC.AlD.Na
科目:高中化学 来源: 题型:
【题目】溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
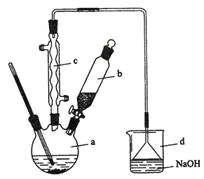
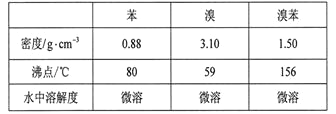
按下列合成步骤回答问题:
(1)在a中加入15 mL无水苯和少量铁屑。在b中小心加入4.0 mL液态溴。向a中滴入几滴溴,有白色烟雾产生,是因为生成了________气体。继续滴加至液溴滴完。装置d的作用是________________;
(2)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10 mL水,然后过滤除去未反应的铁屑;
②滤液依次用l0 mL水、8 mL l0%的NaOH溶液、10 mL水洗涤。NaOH溶液洗涤的作用是________;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤。加入氯化钙的目的是________;
(3)经以上分离操作后,粗溴苯中还含有的主要杂质为______,要进一步提纯,下列操作中必须是______(填入正确选项前的字母);
A重结晶 B过滤 C蒸馏 D萃取
(4)在该实验中,a的容积最适合的是______(填入正确选项前的字母)。
A、25 mL B、50 mL C、250 mL D、509 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A+B = C +D,6g A和12g B恰好完全反应,生成C和9 g D,则A:C
A. 3:2 B. 1:4
C. 1:1 D. 2:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)M2O7x- 与S2-在酸性溶液中发生如下反应:M2O7x- +3S2-+14H+=2M3++3S+7H2O,则x等于________ ,氧化产物与还原产物的物质的量比为_______。
(2)NaHSO4与Ba(OH)2在溶液中按物质的量之比为1:1混合反应的离子方程式_____;
(3)用单线桥标出该反应中电子转移的方向和数目________
Fe3O4 +4CO![]() 3Fe+4CO2
3Fe+4CO2
(4)过量CO2通入NaOH溶液中的离子方程式__________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D 为原子序数依次增大的四种元素,A2和 B+具有相同的电子构型;C、D 为同周期元素,C 核外电子总数是最外层电子数的 3 倍;D 元素最外层有一个未成对电子。回答下列问题:
(1)四种元素中电负性最大的是_____(填元素符号),其中 C 原子的外围电子排布图为_____.
(2)单质 A 有两种同素异形体,其中沸点高的是_________(填分子式),原因是_____;A 和 B 的氢化 物所含的化学键类型分别为_____和_____.
(3)C 和 D 反应可生成组成比为 1:3 的化合物 E,E 的立体构型为_____,中心原子的杂化轨 道类型为_____.
(4)化合物 D2A 的立体构型为_____,中心原子的价层电子对数为_____,单质 D与湿润的 Na2CO3 反应可制备 D2A,其化学方程式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列分子的空间构型可用sp2杂化轨道来解释的是( )
①BF3 ②CH2=CH2 ③![]() ④CH≡CH ⑤NH3 ⑥CH4
④CH≡CH ⑤NH3 ⑥CH4
A. ①②③ B. ①⑤⑥ C. ②③④ D. ③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知35%NaOH溶液的密度为1.38g·cm-3,5%NaOH溶液的密度为1.05g·cm-3,若将上述两种溶液等体积混合,所得NaOH溶液的质量分数是
A. 大于20% B. 等于20% C. 小于20% D. 无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子序数依次增大的五种元素A、B、C、D、E位于周期表的前四周期,A基态原子的2p轨道上有2个未成对电子,C的最外层电子数是次外层电子数的3倍,C与D同主族相邻,E位于周期表的ds区,最外层只有一对成对电子。请回答下列问题:
(1)写出各元素符号:A________,B________,C________,D________,E________。
(2)D元素在元素周期表中的位置是_______________,基态E原子的电子占有_____种能量不同的原子轨道。
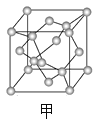
(3)A元素可形成多种单质,其中分子晶体的分子式为________;原子晶体的名称是_______,其每个晶胞(如图甲)实际含有______个A原子;A有一种单质为层状结构的晶体,晶体中存在的作用力有____________,晶体中每个最小环含有_____个原子。
(4)①写出B的单质的电子式___________,化合物AC2的结构式___________。
②用KMnO4酸性溶液吸收DC2气体时,MnO4﹣被还原为Mn2+,该反应的离子方程式为________________________________________________。
(5)D与E能形成化合物X,X的一种晶体晶胞结构如图乙所示,X的化学式为______,D离子的配位数为______;若晶胞边长为a cm,则晶体X的密度计算式为ρ=______________gcm-3(用a和NA的代数式表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据表中信息判断,下列选项正确的是 ( )
序号 | 反应物 | 产物 |
① | KMnO4、H2O2、H2SO4 | K2SO4、MnSO4… |
② | Cl2、FeBr2 | FeCl3、FeBr3 |
③ | MnO | Cl2、Mn2+… |
A. 第①组反应的其余产物只有O2
B. 第②组反应中Cl2与FeBr2的物质的量之比为1∶2
C. 第③组反应中生成1 mol Cl2,转移电子10 mol
D. 氧化性由强到弱顺序为MnO![]() >Cl2>Fe3+>Br2
>Cl2>Fe3+>Br2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com