
【题目】空气中的氧分子在阳光紫外线、闪电等外界因素作用下,会生成氧负离子(O2 - )。O2 -的摩尔质量为( )
A.33 gB.33 g· mol-1C.32 gD.32 g· mol-1
科目:高中化学 来源: 题型:
【题目】氟在自然界中常以CaF2的形式存在。
(1)下列关于CaF2的表述正确的是_____。
a.Ca2+ 与F﹣间仅存在静电吸引作用
b.F﹣的离子半径小于Cl﹣,则CaF2的熔点高于CaCl2
c.阴阳离子比为2∶1的物质,均与CaF2晶体构型相同
d.CaF2中的化学键为离子键,因此CaF2在熔融状态下能导电
(2)CaF2难溶于水,但可溶于含Al3+的溶液中,原因是 _____________________(用离子方程式表示)。
(3)F2通入稀NaOH溶液中可生成OF2,OF2分子构型为_____,其中氧原子的杂化方式为____。
(4)F2与其他卤素单质反应可以形成卤素互化物,例如ClF3、BrF3等。已知反应Cl2(g)+3F2(g)═2ClF3(g)△H=﹣313kJmol﹣1,F﹣F键能159kJmol﹣1,Cl﹣Cl键的键能为242kJmol﹣1,则ClF3中Cl﹣F键的平均键能为________ kJmol﹣1,ClF3的熔、沸点比BrF3的_____(填“高”或“低”)。
(5)如图为CaF2、H3BO3(层状结构,层内的H3BO3分子通过氢键结合)、金属铜三种晶体的结构示意图,请回答下列问题:
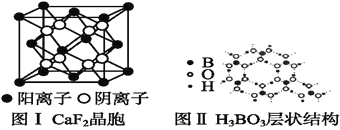
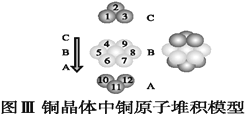
①图Ⅰ所示的CaF2晶胞中与Ca2+最近且等距离的F-数为____,图Ⅲ中未标号的铜原子形成晶体后周围最紧邻的铜原子数为____。
②图Ⅱ所示的物质结构中最外层已达8电子结构的原子是____。H3BO3晶体中B原子个数与极性键个数比为____。
③三种晶体中熔点最低的是____,其晶体受热熔化时,克服的微粒之间的相互作用力为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:X(g)+2Y(g)![]() 3Z(g) △H=-akJ·mol-1(a>0),下列说法不正确的是
3Z(g) △H=-akJ·mol-1(a>0),下列说法不正确的是
A. 0.1molX和0.2molY充分反应生成Z的物质的量一定小于0.3mol
B. 达到化学平衡状态时,X、Y、Z的浓度不再发生变化
C. 达到化学平衡状态时,反应放出的总热量可达a Kj
D. 升高反应温度,逆反应速率增大,正反应速率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知氨可以与灼热的氧化铜反应得到氮气、金属铜和一种氧化物。用下图装置可以实现该反应。
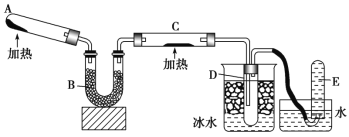
回答下列问题:
(1)A 中发生反应的化学方程式是_____;
(2)B 中加入的物质是____;
(3)实验时在 C 中观察到的现象是______, 发生反应的化学方程式是_______;
(4)实验时在 D 中观察到的现象是出现无色液体,D 中收集到的物质是____,检验该 物质的方法和现象是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,在含CH3COOH和CH3COO-的溶液中, CH3COOH、CH3COO-二者中各自所占的物质的量分数(a)随溶液pH变化的关系如图所示。
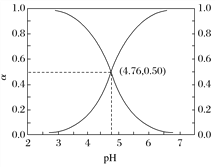
下列说法不正确的是
A. 在pH<4.76的溶液中,c(CH3COO-)<c(CH3COOH)
B. 在pH=7的溶液中,a(CH3COOH)=0,a(CH3COO-)=1.0
C. 在pH>4.76的溶液中,c(CH3COO-)与c(OH-)之和可大于c(H+)
D. 在pH=4.76的溶液中加盐酸,a(CH3COOH)与a(CH3COO-)之和保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃煤会产生CO2、CO、SO2等大气污染物。燃煤脱硫的相关反应的热化学方程式如下:
CaSO4(s)+CO(g) ![]() CaO(s) + SO2(g) + CO2(g) ΔH1 =+281.4kJ/mol (反应Ⅰ)
CaO(s) + SO2(g) + CO2(g) ΔH1 =+281.4kJ/mol (反应Ⅰ)
1/4CaSO4(s)+CO(g) ![]() 1/4CaS(s) + CO2(g) ΔH2 = -43.6kJ/mol (反应Ⅱ)
1/4CaS(s) + CO2(g) ΔH2 = -43.6kJ/mol (反应Ⅱ)
(1)计算反应CaO(s) + 3CO(g ) + SO2(g) ![]() CaS(s) +3 CO2(g) ΔH=____________。
CaS(s) +3 CO2(g) ΔH=____________。
(2)一定温度下,向某恒容密闭容器中加入CaSO4(s)和1molCO,若只发生反应I,下列能说明该反应已达到平衡状态的是_____________(填序号)
a.容器内的压强不发生变化 b.υ正(CO)=υ正(CO2)
c.容器内气体的密度不发生变化 d.n(CO)+n(CO2)=1mol
(3)一定温度下,体积为1L容器中加入CaSO4(s)和1molCO,若只发生反应II,测得CO2的物质的量随时间变化如下图中曲线A所示。
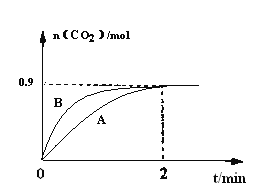
①在0~2min内的平均反应速率v(CO)=____________。
②曲线B表示过程与曲线A相比改变的反应条件可能为____________答出一条即可)。
③若要提高反应体系中CO2的体积分数,可采取的措施为__________________。
(4)一定温度下,向恒容密闭容器中加入CaSO4(s)和1molCO,下列能说明反应I和反应II同时发生的是________________(填代号)。
a.反应后气体能使品红褪色
b.反应过程中,CO的体积分数逐渐减小
c.反应体系达平衡前,SO2和CO2两种气体的浓度之比随时间发生变化
d.体系压强逐渐增大
(5)烟道气中的SO2和CO2均是酸性氧化物,也可用氢氧化钠溶液吸收。
已知:25℃时,碳酸和亚硫酸的电离平衡常数分别为:
碳酸 K1=4.3×10-7 K2=5.6×10-11
亚硫酸K1=1.5×10-2 K2=1.0×10-7
①下列事实中,不能比较碳酸与亚硫酸的酸性强弱的是__________(填标号)。
a.25℃下,饱和碳酸溶液pH大于饱和亚硫酸溶液pH
b.25℃下,等浓度的NaHCO3溶液pH大于NaHSO3溶液
c.将SO2气体通入NaHCO3溶液,逸出气体通入澄清石灰水,澄清石灰水变浑浊
d.将CO2气体通入NaHSO3溶液,逸出气体通入品红溶液,品红溶液不褪色
②25℃时,氢氧化钠溶液吸收烟道气,得到pH=6的吸收液,该溶液中c(SO32-):c(HSO3-)=___________。
③H 2SO3溶液和NaHCO3溶液反应的主要离子方程式为____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤素单质及其化合物是物质世界不可缺少的组成部分。请利用所学物质结构与性质的相关知识回答下列问题:
(1)At原子的核外价电子排布式为______________________;I3+中心原子杂化方式为_______;ClO2-的空间构型为__________。基态氟原子核外电子有________种空间运动状态。
(2)已知高碘酸有两种结构,化学式分别为H5IO6( )和HIO4;前者为五元酸,后者为一元酸,请比较二者的酸性强弱:H5IO6 ______HIO4(填“>”、“=”或“<”).
)和HIO4;前者为五元酸,后者为一元酸,请比较二者的酸性强弱:H5IO6 ______HIO4(填“>”、“=”或“<”).
(3)TiCl4熔点为-24℃,沸点为136.4℃。可溶于甲苯,固态TiCl4属于_________晶体。
(4)用锌还原TiCl4的盐酸溶液,可制得绿色配合物[TiCl(H2O)5]Cl2·H2O。1mol该配合物中含有σ键数目为__________。
(5)CaF2晶胞结构如下图

①晶体中距离最近的2个Ca2+(X)与一个F-(Y)形成的夹角(∠XYX)为___________。
②CaF2的摩尔质量为78g/mol,晶胞密度为ρg/cm3,阿伏加德罗常数为NA,则晶体中两个最近的Ca2+间中心距离为____________cm
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴苯是不溶于水的液体,常温下不与酸、碱反应,可用如图装置制取(该反应放出热量)。制取时观察到锥形瓶中导管口有白雾出现等现象。下列说法错误的是
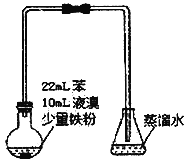
A. 制备溴苯的反应属于取代反应
B. 该反应过程中还可能看到烧瓶中有红色蒸汽
C. 装置图中长直玻璃导管仅起导气作用
D. 溴苯中溶有少量的溴,可用NaOH溶液洗涤除去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作能够达到实验目的的是( )
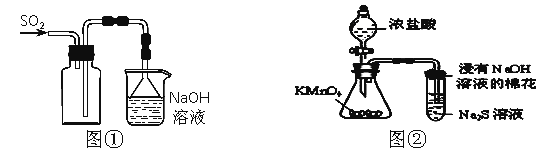
A.实验室采用图①所示装置收集SO2
B.可用图②所示装置比较KMnO4、Cl2、S的氧化性强弱
C.实验室四氯化碳中常含有少量溴,加适量的苯,振荡、静置后分液,可除去四氯化碳中的溴
D.称取0.40 g NaOH,直接置于100 mL容量瓶中加水至刻度线,可配制0.10 mol/L NaOH溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com