
在一定条件下,PbO2与Cr3+反应,产物是Cr2O72—和 Pb2+,则与1molCr3+反应所需PbO2的物质的量为( )
A.3.0 mol B.1.5mol C.1.0mol D.0.75mol
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
硫代硫酸钠(Na2S2O3·5H2O)俗名“大苏打”,又称为“海波”,可用于照相业作定影剂,也可用于纸浆漂白作脱氯剂等。它易溶于水,难溶于乙醇,加热、遇酸均易分解。工业上常用亚硫酸钠法、硫化碱法等制备。某实验室模拟工业硫化碱法制取硫代硫酸钠,其反应装置及所需试剂如下图:
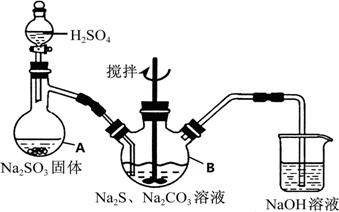
实验具体操作步骤为:
①开启分液漏斗,使硫酸慢慢滴下,适当调节分液的滴速,使反应产生的SO2气体较均匀地
通入Na2S和Na2CO3的混合溶液中,同时开启电动搅拌器搅动,水浴加热,微沸。
②直至析出的浑浊不再消失,并控制溶液的pH接近7时,停止通入SO2气体。
③趁热过滤,将滤液加热浓缩,冷却析出Na2S2O3·5H2O。
④再经过滤、洗涤、干燥,得到所需的产品。
(1)写出仪器A的名称 步骤④中洗涤时,为了减少产物的损失用的试剂可以是 。
(2)为了保证硫代硫酸钠的产量,实验中不能让溶液pH<7,请用离子方程式解释原因 。
(3)写出三颈烧瓶B中制取Na2S2O3反应的总化学反应方程式
。
(4)最后得到的产品中可能含有Na2SO4杂质。请设计实验检测产品中是否存在Na2SO4,简要说明实验操作,现象和结论:
。
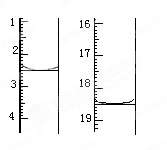 (5)测定产品纯度
(5)测定产品纯度
准确称取1.00 g产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.100 0 mol·L-1碘的标准溶液滴定。反应原理为2S2O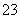 +I2===S4O
+I2===S4O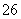 +2I-。滴定起始和终点的液面位置如图:
+2I-。滴定起始和终点的液面位置如图:
则消耗碘的标准溶液体积为_______mL。产品的纯度为
%。
(6)Na2S2O3常用作脱氯剂,在溶液中易被Cl2氧化成SO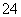 ,该反应的离子方程式为______________________________。
,该反应的离子方程式为______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,对pH=10的NaHCO3溶液中,各微粒的物质的量浓度分析正确的是( )
A.c(CO32—)>c(H2CO3)
B.c(Na+)>c(HCO3—)>c(OH—)>c(H+)
C.c(Na+)+c(H+)=c(HCO3—)+c(CO32—)+c(OH—)
D.c(Na+)=c(HCO3—)+c(CO32—)
查看答案和解析>>
科目:高中化学 来源: 题型:
重铬酸钠(Na2Cr2O7·2H2O)俗称红矾钠,在工业方面有广泛用途。我国目前主要是以铬铁矿(主要成份为FeO·Cr2O3,还含有Al2O3、MgO、SiO2等杂质)为主要原料进行生产,其主要工艺流程如下:
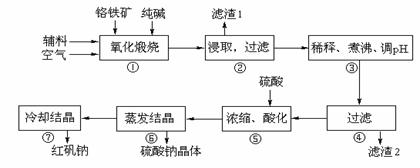
①中涉及的主要反应有:
主反应:4FeO·Cr2O3+8Na2CO3+7O2  8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2
副反应:SiO2+Na2CO3 Na2SiO3+CO2↑、Al2O3+Na2CO3
Na2SiO3+CO2↑、Al2O3+Na2CO3 2NaAlO2+CO
2NaAlO2+CO 2↑
2↑
部分阳离子以氢氧化物形式完全沉淀时溶液的pH:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Mg(OH)2 | Cr(OH)3 |
| 完全沉淀时溶液pH | 4.7 | 3.7 | 11.2 | 5.6 |
试回答下列问题:
⑴“①”中反应是在回转窑中进行 ,反应时需不断搅拌,其作用是
,反应时需不断搅拌,其作用是
⑵ “③”中调节pH至4.7,目的是 。
⑶ “⑤”中加硫酸酸化的目的是使CrO42-转化为Cr2O72-,请写出该平衡转化的离子方程式: 。
( 4)称取重铬酸钠试样2.5000 g配成250 mL溶液,取出25.00 mL于碘量瓶中,加入10 mL 2 mol·L-1H2SO4和足量碘化钠(铬的还原产物为Cr3+),放
4)称取重铬酸钠试样2.5000 g配成250 mL溶液,取出25.00 mL于碘量瓶中,加入10 mL 2 mol·L-1H2SO4和足量碘化钠(铬的还原产物为Cr3+),放 于暗处5 min,然后加入100 mL水,加入3 mL淀粉指示剂,用0.1200 mol·L-1Na2S2O3标准溶液滴定(I2+2S2O32-=2I-+S4O62-)。
于暗处5 min,然后加入100 mL水,加入3 mL淀粉指示剂,用0.1200 mol·L-1Na2S2O3标准溶液滴定(I2+2S2O32-=2I-+S4O62-)。
①判断达到滴定终点的依据是:____________________________________;
②若实验中共用去Na2S2O3标准溶液40.00 mL,所得产品的中重铬酸钠的纯度(设整个过程中其它杂质不参与反应)__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
固体硝酸盐加热易分解且产物较复杂。某学习小组以Mg(NO3)2为研究对象,拟通过实验探究其热分解的产物,提出如下4种猜想:
甲:Mg(NO2)2、NO2、O2 乙:MgO、NO2、O2 丙:Mg3N2、O2 丁:MgO、NO2、N2
实验前,小组成员经讨论认定猜想丁不成立,理由是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)在热的稀硫酸溶液中溶解了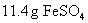 .当加入
.当加入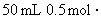
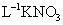 溶液后,使其中的
溶液后,使其中的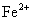 全部转化成
全部转化成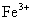 ,
,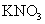 也反应完全,并有
也反应完全,并有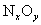 氮氧化物气体逸出.
氮氧化物气体逸出.
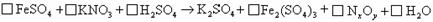
①推算出x=________,y=________. ②配平该化学方程式(系数填写在上式方框内)
③反应中氧化剂为________. ④用短线和箭头标出电子转移的方向和总数.
(2)油画所用颜料含有某种白色的铅化合物,置于空气中,天长日久就会生成黑色PbS,从而使油画的色彩变暗,若用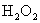 来“清洗”,则可将PbS转变为白色的
来“清洗”,则可将PbS转变为白色的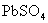 而使油画“复原”.请填空:①上述“清洗”反应的化学方程式为________________________________.
而使油画“复原”.请填空:①上述“清洗”反应的化学方程式为________________________________.
②若有0.1 mol的PbS参加反应,则在此反应中发生转移的电子为________mol.
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室可由软锰矿(主要成分为MnO2)制备KMnO4,方法如下:软锰矿与过量固体KOH和KClO3在高温下反应,生成锰酸钾(K2MnO4)和KCl;用水溶解,滤去残渣,滤液酸化后,K2MnO4转变为MnO2和KMnO4;滤去MnO2沉淀,浓缩滤液,结晶得到深紫色的针状KMnO4。 请回答:

查看答案和解析>>
科目:高中化学 来源: 题型:
锌和二氧化锰是电池工业中的主要原料,其中一种Zn—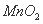 同槽电解的工业生产试验工艺流程涉及的主要反应有: ①
同槽电解的工业生产试验工艺流程涉及的主要反应有: ①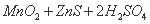 ===
===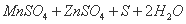
 ②
②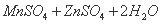
 下列说法正确的是( )
下列说法正确的是( )
A.①中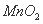 是氧化剂
是氧化剂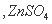 是还原产物
是还原产物
B.①中每产生16 g S时转移电子的物质的量为2 mol
C.按照②电解时,生成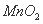 的电极为阴极
的电极为阴极
D.该工艺流程中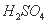 可循环
可循环
查看答案和解析>>
科目:高中化学 来源: 题型:
在含Al3+、Fe3+、Fe2+、NH4 +的稀溶液中,加入足量的Na2O2固体,充分作用后,再加入过量稀盐酸完全反应,离子数目基本不变的是( )
+的稀溶液中,加入足量的Na2O2固体,充分作用后,再加入过量稀盐酸完全反应,离子数目基本不变的是( )
A.Al3+ B.Fe3+ C.Fe2+ D.NH4+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com