
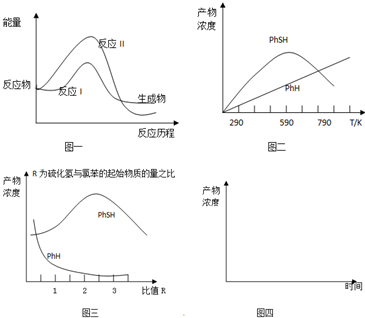
分析 (1)化学平衡常数为生成物浓度系数次幂的乘积与反应物浓度系数次幂乘积的比;由图1可知,Ⅱ中反应物总能量高于生成物总能量,反应Ⅱ为放热反应;
(2)活化能越高,反应速率应越慢;
(3)①开始时,反应Ⅰ速率大于反应Ⅱ速率,所以生成苯硫酚浓度大于苯;反应Ⅰ达到平衡后,温度升高,平衡逆向移动,所以生成物苯硫酚浓度减小;反应Ⅱ是不可逆反应,温度升高反应速率加快,生成的苯浓度增加,消耗了反应物,进一步导致反应Ⅰ逆向移动;
②由图三可知,R=2.5时PhSH浓度最大,由图二可知,温度590K时PhSH浓度最大;
(4)恒温恒容条件下,苯硫酚的物质的量随反应进行浓度增大,到达平衡后浓度最大,而平衡后苯浓度增加,消耗了反应物,导致反应Ⅰ逆向移动,苯硫酚的物质的量减小.
解答 解:(1)化学平衡常数为生成物浓度系数次幂的乘积与反应物浓度系数次幂乘积的比,反应Ⅰ的平衡常数的表达式K=$\frac{c(PhSH)×c(HCl)}{c(PhCl)×c({H}_{2}S)}$;由图1可知,Ⅱ中反应物总能量高于生成物总能量,反应Ⅱ为放热反应,故△H<0,
故答案为:$\frac{c(PhSH)×c(HCl)}{c(PhCl)×c({H}_{2}S)}$;<;
(2)活化能Ⅱ>I,活化能越高,单位体积内活化分子数目越小,反应速率应越慢,故反应速率v(Ⅰ)>v(Ⅱ),
故答案为:>;
(3)①开始时,反应Ⅰ速率大于反应Ⅱ速率,所以生成苯硫酚浓度大于苯;反应Ⅰ达到平衡后,温度升高,平衡逆向移动,所以生成物苯硫酚浓度减小;反应Ⅱ是不可逆反应,温度升高反应速率加快,生成的苯浓度增加,消耗了反应物,进一步导致反应Ⅰ逆向移动,PhSH的浓度又降低,
故答案为:开始时,反应Ⅰ速率大于反应Ⅱ速率,所以生成苯硫酚浓度大于苯;反应Ⅰ达到平衡后,温度升高,平衡逆向移动,所以生成物苯硫酚浓度减小;反应Ⅱ是不可逆反应,温度升高反应速率加快,生成的苯浓度增加,消耗了反应物,进一步导致反应Ⅰ逆向移动;
②由图三可知,R=2.5时PhSH浓度最大,由图二可知,温度590K时PhSH浓度最大,故采取措施为:,
故答案为:R=2.5,温度控制在590K;
(4)恒温恒容条件下,苯硫酚的物质的量随反应进行浓度增大,到达平衡后浓度大最大,而平衡后苯浓度增加,消耗了反应物,导致反应Ⅰ逆向移动,苯硫酚的物质的量减小,苯硫酚的物质的量随时间变化的曲线图为: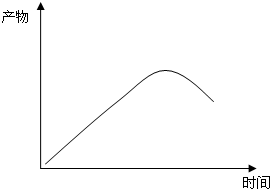 ,
,
故答案为: .
.
点评 本题考查化学反应速率及化学平衡图象综合应用、平衡常数、化学反应能量变化等,是对学生综合能力的考查,难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 氢气在氯气中燃烧,发出苍白色火焰,瓶口上方有白色烟雾 | |
| B. | 铜在氯气中燃烧,产生棕黄色烟,产物溶于水,溶液呈蓝绿色 | |
| C. | 铁丝在氯气中燃烧,产生红色的浓烟,产物溶于水,溶液呈浅绿色 | |
| D. | 钠在空气中燃烧,发出黄色的火焰,生成白色固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | ① | ② | ③ | ④ | ⑤ | ⑥ |
| 仪器及装置图 |  |  |  |  |  |  |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同物质的量浓度的三种溶液的pH:a>b>c | |
| B. | 同pH时,三种溶液稀释相同倍数后,pH:a>b<c | |
| C. | 同pH、同体积的三种溶液消耗同浓度盐酸 的体积:a=b=c | |
| D. | 同pH时,稀释不同倍数、pH仍相同,三种溶液稀释的倍数:a>b>c |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:3.4 | B. | 1:1.7 | C. | 2.6:1 | D. | 4.6:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 )相同,且同时符合下列两个条件:①苯环上带有两个取代基,②有一个硝基直接连在苯环上,则符合此条件的同分异构体数目是( )
)相同,且同时符合下列两个条件:①苯环上带有两个取代基,②有一个硝基直接连在苯环上,则符合此条件的同分异构体数目是( )| A. | 3 | B. | 5 | C. | 6 | D. | 10 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol Cl2参加反应,转移的电子数目一定为0.2NA | |
| B. | 1.4g聚乙烯中含C-H数目为0.2NA | |
| C. | 标准状况下,5.6L甲醇中含有的分子数目为0.2NA | |
| D. | 常温下,pH=13的NaOH溶液中含OH-的数目为0.1NAA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com