
【题目】下列说法不正确的是( )
A. 用加热法可除去Na2CO3中的NaHCO3
B. Na2CO3的热稳定性大于NaHCO3
C. 可用石灰水区分Na2CO3与NaHCO3溶液
D. Na2CO3和NaHCO3的水溶液均显碱性
 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:
【题目】在100mL MgCl2和AlCl3的混和溶液中,逐滴加入NaOH溶液直至过量,经测定,加入NaOH物质的量和所得沉淀的物质的量的关系如图所示。回答下列问题。

(1)图中CD段反应的化学方程式为___________;C点存在的固体物质为________。
(2)A点的数据为_______;混合液中,MgCl2的浓度为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、铝、铜等金属及其化合物在日常生活中应用广泛,请根据下列实验回答问题:
(1)生铁中含有一种铁碳化合物X(Fe3C)。X在足量的空气中高温煅烧,生成有磁性的固体Y,将Y溶于过量盐酸的溶液中含有的大量阳离子是___。
(2)某溶液中有Mg2+、Fe2+、Al3+、Cu2+等四种离子,向其中加入过量的NaOH溶液后,过滤,将滤渣高温灼烧并将灼烧后的固体投入过量的稀盐酸中,所得溶液与原溶液相比,溶液中大量减少的阳离子是______________。
A.Mg2+ B.Fe2+ C.Al3+ D.Cu2+
(3)氧化铁是重要工业颜料,用废铁屑制备它的流程如下:

回答下列问题:
①操作Ⅰ的名称是____,操作Ⅱ的名称是____。②写出在空气中煅烧FeCO3的化学方程式________________。
(4)有些同学认为KMnO4溶液滴定也能进行铁元素含量的测定。
a.称取2.850 g绿矾(FeSO4·7H2O)产品,溶解,在250 mL容量瓶中定容;
b.量取25.00 mL待测溶液放入锥形瓶中;
c.用硫酸酸化的0.01000 mol·L-1KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00 mL。
①达到滴定终点时的现象____。
②某同学设计的下列滴定方式,最合理的是____。(夹持部分略去)(填字母序号)
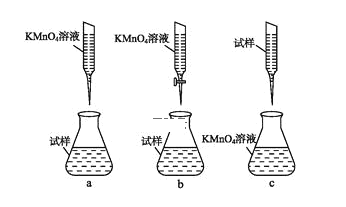
③计算上述样品中FeSO4·7H2O的质量分数为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法中正确的数目是
①12.0g熔融的NaHSO4中含有的阳离子数为0.2NA
②1mol Na2O 和Na2O2混合物中含有的阴、阴离子总数是3NA
③常温常压下,92g的NO2和N2O4混合气体含有的原子数为6NA
④7.8g![]() 中含有的碳碳双键数目为0.3NA
中含有的碳碳双键数目为0.3NA
⑤用1L1.0 mol/LFeCl3溶液制备氢氧化铁胶体,所得氢氧化铁胶粒的数目为NA
⑥1mol SO2与足量O2在一定条件下充分反应生成SO3,共转移2NA个电子
⑦在反应KIO3+6HI=KI+3I2 +3H2O 中,每生成3molI2转移的电子数为5NA
⑧常温常压下,17 g甲基(-14CH3)中所含的中子数为9NA
A. 3 B. 4 C. 5 D. 6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究Cl2、Br2、Fe3+的氧化性强弱,设计了如下实验:

(1)①装置A中发生反应的离子方程式是_____________________。
②整套实验装置存在一处明显的不足,请指出_______________________。
(2)用改正后的装置进行实验,实验过程如下:
实验操作 | 实验现象 | 结论 |
打开活塞a,向圆底烧瓶中滴入适量浓盐酸;然后关闭活塞a,点燃酒精灯。 | D装置中:溶液变红 E装置中:水层溶液变黄, 振荡后,下层CCl4层无明显变化。 | Cl2、Br2、Fe3+的氧化性由强到弱的顺序为: ________________________ |
(3)因忙于观察和记录,没有及时停止反应,D、E中均发生了新的变化。
D装置中:红色慢慢褪去。
E装置中:CCl4层先由无色变为橙色,后颜色逐渐加深,直至变成红色。
为探究上述实验现象的本质,小组同学查得资料如下:
ⅰ.Fe3+ +3SCN-![]() Fe(SCN)3 是一个可逆反应。
Fe(SCN)3 是一个可逆反应。
ⅱ.(SCN)2性质与卤素单质类似。氧化性:Cl2 > (SCN)2 。
ⅲ.Cl2和Br2反应生成BrCl,BrCl呈红色(略带黄色),沸点约5℃,它与水能发生水解反应,且该反应为非氧化还原反应。
ⅳ.AgClO、AgBrO均可溶于水。
①请用平衡移动原理(结合上述资料)解释Cl2过量时D中溶液红色褪去的原因___________________________________________,现设计简单实验证明上述解释:取少量褪色后的溶液,滴加______________溶液,若溶液颜色________,则上述解释是合理的。
②欲探究E中颜色变化的原因,设计实验如下:
用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生。请结合上述资料用两步方程式(离子或化学方程式不限定)解释产生白色沉淀原因__________________、_______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合物X由Al2O3、Fe2O3、Cu、SiO2中的一种或几种物质组成。某校课外兴趣小组以两条途径分别对X进行如下实验探究,下列有关说法正确的是

A. 由图可知X中一定存在Fe2O3
B. 不可以判断混合物中是否含有Al2O3
C. 混合物X中含0.64gCu
D. Ⅰ中发生的反应的离子方程式为Cu+2H+=Cu2++H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有五瓶损坏标签的试剂,分别盛有AgNO3溶液、稀硝酸、盐酸、氯化钡溶液、碳酸钾溶液,为了确定各瓶中是什么试剂,将它们任意编号为A、B、C、D、E,用小试管各盛少量多次进行两两混合反应,反应现象为:A与B、A与E均可产生白色沉淀,其中A与B反应所产生沉淀不溶于酸,A与E反应所生成的白色沉淀可以溶于C或D;B与D、B与E产生沉淀;E与C、E与D反应均可产生二氧化碳气体;而C与D由于属于同一类物质,混合时无反应现象。
由此,可判定各试剂瓶中所盛试剂为(用化学式表示)
A________;B________;C________;D________;E________。
另外,请写出下面要求的离子方程式:
(1)A与E:
________________________________________________________。
(2)A与B:
_________________________________________________________。
(3)C与E:
__________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知氯化铝的熔点为190℃(2.02×105Pa),但它在180℃即开始升华。
(1)氯化铝是________________(填“离子化合物”或“共价化合物”)。
(2)在500K和1.01×105Pa时,它的蒸气密度(换算成标准状况时)为11.92g·L-1,且已知它的结构中有配位键(当共价键中共用的电子对是由其中一原子独自供应,另一原子提供空轨道时,就形成配位键)。配位键形成后,就与一般共价键无异,氯化铝的化学式为________,结构式为________。
(3)无水氯化铝在空气中强烈地“发烟”,其原因是______________________。
(4)设计一个更可靠的实验,判别氯化铝是离子化合物还是共价化合物。你设计的实验是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需纯净的NaCl晶体,但现有的NaCl晶体中混有少量的Na2SO4和NH4HCO3,为除去杂质,甲同学设计了如下实验:(已知NH4HCO3 ![]() NH3↑+H2O+CO2↑)
NH3↑+H2O+CO2↑)
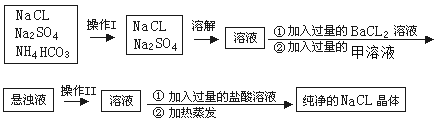
(1)上述操作I、II的名称分别为______、_______
(2)进行操作“加入过量的BaCl2溶液”时,如何判断BaCl2溶液已过量,其方法是______________________________________________________
(3)操作“加入过量的甲溶液”,甲溶液为______溶液,此操作的目的是________________________。
(4)操作“加入过量的盐酸溶液”的目的是________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com