
【题目】工业上将Na2CO3和Na2S以1:2的物质的量之比配成溶液,再通入SO2,可制取Na2S2O3,同时放出CO2。在该反应中
A. 硫元素被氧化
B. 氧化剂与还原剂的物质的量之比为1:2
C. 每生成1molNa2S2O3,转移4mol电子
D. 相同条件下,每吸收10m3SO2就会放出2.5m3CO2
科目:高中化学 来源: 题型:
【题目】同学们已经学习了几种典型的有机化学反应类型——取代反应、加成反应、酯化反应。写出下列反应的化学反应方程式,并判断其反应类型。
①乙醇与金属钠反应:_____________________________,属于___________反应;
②由苯制取硝基苯:_______________________________,属于____________反应;
③由苯制取环己烷:_______________________________,属于____________反应;
④乙烯使溴水褪色:_______________________________,属于____________反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是石蜡油在炽热碎瓷片的作用下产生 C2H4 并检验 C2H4 性质的实验。请回答下列问题:
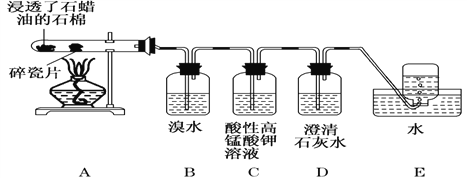
(1)C2H4的电子式:_________。
(2)B 装置中反应的化学方程式为:____________。
(3)C 装置中可观察到的现象是__________。
(4)查阅资料知,乙烯与酸性高锰酸钾溶液反应产生二氧化碳。根据本实验中装置________(填字母)中的实验现象可判断该资料是否真实。
(5)通过上述实验探究,除去甲烷中乙烯的方法是______。
A.气体通入水中
B.气体通过盛溴水的洗气瓶
C.气体通过盛酸性高锰酸钾溶液的洗气瓶
D.气体通过氢氧化钠溶液
某种烯烃与H2 1:1加成后的产物如图所示:则该烯烃的结构有_______种。
(6)苯和乙烯都是石油化工的重要原料,苯和溴反应的方程式:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知草酸为二元弱酸H2C2O4![]() HC2O4-+H+,Ka1;HC2O4-
HC2O4-+H+,Ka1;HC2O4-![]() C2O42-+H+ Ka1;常温下,向某浓度的草酸溶液中逐滴加入一定量浓度的KOH溶液,所得溶液中H2C2O4、HC2O4-、C2O42-三种微粒的物质的量分数(δ)与溶液pH的关系如图所示,则下列说法中不正确的是
C2O42-+H+ Ka1;常温下,向某浓度的草酸溶液中逐滴加入一定量浓度的KOH溶液,所得溶液中H2C2O4、HC2O4-、C2O42-三种微粒的物质的量分数(δ)与溶液pH的关系如图所示,则下列说法中不正确的是

A. pH=1.2溶液中:c(K+)+c(H+)=c(OH-)+c(H2C2O4)
B. pH=2.7溶液中:c2(HC2O4-)/[c(H2C2O4)×c(C2O42-)]=1000
C. 将相同物质的量KHC2O4和K2C2O4固体完全溶于水所得混合液的pH为4.2
D. 向pH=1.2的溶液中加KOH溶液将pH增大至4.2的过程中水的电离程度一直增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化学基础填空题:
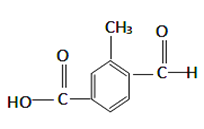
⑴具有复合官能团的复杂有机物中官能团具有各自的独立性,在不同条件下所发生的化学反应可分别从各官能团讨论。根据上图回答:该物质具有的官能团是_______________、_____________(填化学式),所以该物质即可以归为_____________类又可以归为____________类(填有机物的类别)。
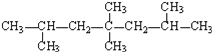
⑵写出下列化合物的名称或结构简式:
①结构简式为 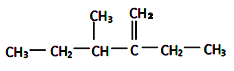
此烃的名称为__________________
②结构简式为 此烃的名称为_______________
此烃的名称为_______________
③2,4-二甲基已烷的结构简式为_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物G是某种新型药物的中间体,其合成路线如下:
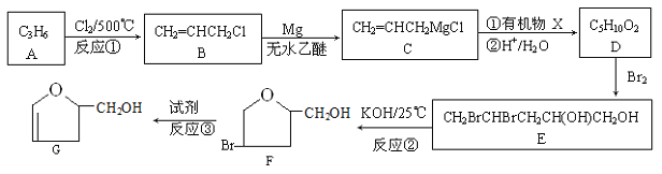
已知: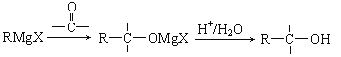
回答下列问题:
(1)F的质谱图中,最大质荷比的数值是___________;
(2)写出反应③所需要的试剂_______;反应②的反应类型是___________;
(3)有机物B中所含官能团的名称是__________;
(4)写出有机物X的结构简式__________;
(5)写出由E到F的化学方程式__________;
(6)A所有的链状二氯取代物同分体数目有__________种;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在甲、乙、丙、丁四个恒容密闭容器中投入H2和I2,发生反应:H2 (g) +I2 (g)![]() 2HI(g).反应体系中各物质浓度的有关数据如下。
2HI(g).反应体系中各物质浓度的有关数据如下。
容器 | 起始浓度 | 平衡浓度 | |
c(H2)/mol·L-1 | c(I2)/mol·L-1 | c(HI)/mol·L-1 | |
甲 | 0.01 | 0.01 | 0.004 |
乙 | 0.01 | 0.02 | a |
丙 | 0.02 | 0.01 | b |
丁 | 0.02 | 0.02 | —— |
下列判断正确的是
A. HI的平衡浓度:a=b>0.004
B. 平衡时,H2的转化率:丁>甲
C. 平衡时,乙中H2的转化率等于20%
D. 丙中条件下,该反应的平衡常数K=4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,组成一种原电池.试回答下列问题:

(1)电解质溶液为稀H2SO4时,若灯泡亮,则Mg电极上发生的反应为:______________;溶液的pH______(填“增大”、“减小”或“不变”).
(2)电解质溶液为NaOH(aq)时,若灯泡亮,则Mg电极为电池的______极(填“正”或“负”).若产生标况下33.6L气体,则溶液增重______g
(3)再次更换一种电解质溶液,组成原电池,使得溶液质量减少,请写出一种可能的电解质溶液_________ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com