
| A. | 其溶液中的c(OH-)=0.1mol•L-1 | |
| B. | 加水稀释后,水电离出的c(OH-)变大 | |
| C. | 加水稀释后,溶液中c(NH4+)•c(OH-)变大 | |
| D. | 与AlCl3溶液发生反应的离子方程式为:Al3++3OH-═Al(OH)3↓ |
分析 A.一水合氨是弱电解质,在水溶液中部分电离;
B.碱抑制水电离,在水溶液中碱电离出c(OH-)越大,则碱抑制水电离程度越大;
C.加水稀释促进一水合氨电离,但一水合氨电离增大程度小于溶液体积增大程度,所以稀释过程中c(NH4+)、c(OH-)都减小;
D.一水合氨是弱电解质,在离子反应中要写化学式.
解答 解:A.一水合氨是弱电解质,在水溶液中部分电离,则溶液中c(OH-)小于氨水浓度,即小于0.10mol/L,故A错误;
B.碱抑制水电离,在水溶液中碱电离出c(OH-)越大,则碱抑制水电离程度越大,加水稀释后一水合氨电离出的c(OH-)减小,则溶液中水电离出的c(OH-)增大,故B正确;
C.加水稀释促进一水合氨电离,但一水合氨电离增大程度小于溶液体积增大程度,所以稀释过程中c(NH4+)、c(OH-)都减小,所以溶液中c(NH4+)•c(OH-)变小,故C错误;
D.一水合氨是弱电解质,在离子反应中要写化学式,离子方程式为Al3++3NH3•H2O=Al(OH)3↓+3NH4+,故D错误;
故选B.
点评 本题考查弱电解质的电离,为高频考点,涉及弱电解质的电离、离子方程式的书写等知识点,把握弱电解质的电离特点及离子方程式书写规则是解本题关键,易错选项是BC,题目难度不大.


科目:高中化学 来源:2016-2017学年西藏拉萨中学高二上第一次月考化学试卷(解析版) 题型:选择题
在一定条件下,对于A2(g)+3B2(g)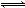 2AB3(g)反应来说,以下化学反应速率的表示中,化学反应速率最快的是
2AB3(g)反应来说,以下化学反应速率的表示中,化学反应速率最快的是
A.v(A2)= 30 mol·L-1·min-1 B.v(A2)= 0.8 mol·L-1·s-1
C.v(AB3)=1.0 mol·L-1·s-1 D.v(B2)=1.2 mol·L-1·s-
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 将5 mL pH=11的X、Y两种碱分别稀释至500 mL,其pH与溶液体积(V)的关系如图,下列说法正确的是( )
将5 mL pH=11的X、Y两种碱分别稀释至500 mL,其pH与溶液体积(V)的关系如图,下列说法正确的是( )| A. | 若X、Y都是弱碱,则a的值一定大于9 | |
| B. | 完全中和X、Y两溶液时,消耗同浓度稀硫酸的体积V(X)>V(Y) | |
| C. | 稀释后X溶液中水的电离程度比Y溶液中水的电离程度小 | |
| D. | 若X、Y是一元碱,则等物质的量浓度的Y的硝酸盐溶液的pH比X的硝酸盐溶液大 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 新制氯水可使蓝以石蕊试纸先变红,后褪色 | |
| B. | 新制氯水中只含有Cl2和H2O分子 | |
| C. | 氯水放置数天后,酸性增强 | |
| D. | 光照氯水有气泡逸出,该气体是Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com