
科目:高中化学 来源: 题型:实验题
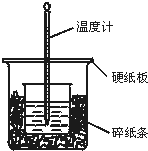 50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
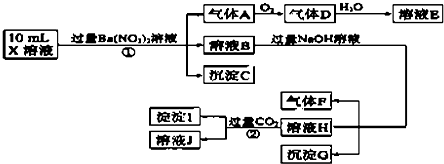
| A. | 由实验①可知,气体A一定是NO,沉淀C一定是BaSO4,原溶液中肯定含有SO32- | |
| B. | 溶液E和气体F不能发生化学反应 | |
| C. | 由实验 ②可知,沉淀I可能是Al(OH)3和BaCO3 | |
| D. | 原溶液中肯定含有Al3+、NH4+、Fe2+、SO42-、Cl-,不能确定是否含有Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸和醋酸反应时放出氢气一样多 | B. | 反应后醋酸溶液中锌粉有剩余 | ||
| C. | 稀释后溶液中的c(H+)硫酸比醋酸大 | D. | 反应开始时醋酸中的反应速率大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子半径:Na+>Mg2+>Al3+ | B. | 原子半径:Na<Mg<Al | ||
| C. | 离子的氧化性:Na+>Mg2+>Al3+ | D. | 单质的还原性:Na<Mg<Al |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
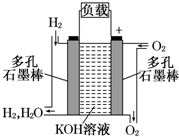
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铊是银白色的金属 | B. | 能置换出盐酸中氢离子 | ||
| C. | 能生成+3价的化合物 | D. | 氢氧化铊是两性氢氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
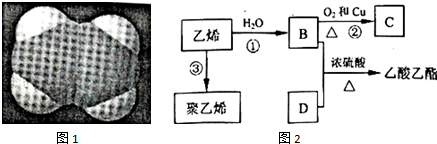
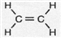 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com