

分析 根据各元素在周期表中的相对位置可知,a为Na、b为H、c为Mg、d为K、e为Si、f为Al、g为Ne、h为O、i为F、j为S、k为Cl元素,
(1)同一主族中,原子序数越大原子半径越大,同一周期中原子序数越大原子半径越小;稀有气体的性质最稳定;
(2)海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒杀菌剂,则该元素是Cl元素;氯原子的原子序数为17,据此判断其在周期表中的位置;氯气与水反应生成次氯酸,次氯酸具有强氧化性,能够杀菌消毒;
(3)f的最高价氧化物为氧化铝,d的最高价氧化物的水化物氢氧化钾,氧化铝与氢氧化钾反应生成偏铝酸钾和水;
(4)e的单质为晶体硅,属于原子晶体;
(5)水分子间含氢键,沸点高.
解答 解:根据各元素在周期表中的相对位置可知,a为Na、b为H、c为Mg、d为K、e为Si、f为Al、g为Ne、h为O、i为F、j为S、k为Cl元素,
(1)在表中所给元素中,K元素位于第三周期ⅠA族,其原子半径最大;Ne最外层达到8电子稳定结构,其性质最稳定,
故答案为:K;Ne;
(2)单质或化合物也是自来水生产过程中常用的消毒杀菌剂,其单质为氯气,Cl元素原子序数为17,位于周期表中第三周期ⅤⅡA族;氯气做消毒杀菌剂的原因是生成HClO,该反应方程式为:Cl2+H2O=HCl+HClO,
故答案为:第三周期ⅤⅡA族;Cl2+H2O=HCl+HClO;
(3)f为Al,其氧化铝为氧化铝,d为K,其最高价氧化物对应水合物为KOH,Al2O3溶于KOH溶液生成KAlO2和H2O,反应的离子方程式为:Al2O3+2OH-=2AlO2-+H2O,
故答案为:Al2O3+2OH-=2AlO2-+H2O;
(4)e为Si元素,其单质为硅,硅晶体属于原子晶体,
故答案为:原子晶体;
(5)b和h组成化合物为H2O,b和j组成化合物为H2S,由于水分子间存在氢键,导致水分子间作用力增大,其沸点高,
故答案为:高;水分子间存在氢键.
点评 本题考查位置结构与性质关系的应用,题目难度中等,明确原子结构与元素周期表的关系为解答关键,注意熟练掌握常见元素及其化合物性质,试题培养了学生的分析能力及综合应用能力.


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:解答题
 在一定温度下,冰醋酸加水稀释过程中溶液的导电能力如图所示,请回答:
在一定温度下,冰醋酸加水稀释过程中溶液的导电能力如图所示,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若反应过程中消耗1mol氯气,则1mol<转移电子数<$\frac{5}{3}$mol | |
| B. | 反应停止后n(NaClO):n(NaCl):n(NaClO3)(物质的量之比)可能为1:11:2 | |
| C. | 反应过程中消耗氯气与NaOH的物质的量之比为1:2 | |
| D. | 氧化产物为NaClO和NaClO3,反应过程中n(NaClO):(NaClO3)为1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 沸点:H2O>H2Se>H2S | B. | 熔点:Na>Mg>Al | ||
| C. | 晶格能:NaF>NaCl>NaBr | D. | 硬度:MgO>CaO>BaO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaAlO2溶液中通入过量的CO2:2AlO2-+3H2O+CO2═2Al(OH)3↓+CO32- | |
| B. | 向海带灰浸出液中加入稀硫酸、双氧水:2I-+2H++H2O2═I2+2H2O | |
| C. | 磨口玻璃试剂瓶被烧碱溶液腐蚀:SiO2+2Na++2OH-═Na2SiO3↓+H2O | |
| D. | NaHCO3溶液和少量Ba(OH)2溶液混合:HCO3-+OH-+Ba2+═H2O+BaCO3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 受热时Na2CO3较NaHCO3更不稳定,更易分解产生CO2 | |
| B. | 等质量的Na2CO3、NaHCO3与足量盐酸反应,前者产生的CO2更多 | |
| C. | 常温下相同物质的量浓度的Na2CO3、NaHCO3溶液,前者碱性更强 | |
| D. | 向Na2CO3、NaHCO3溶液中分别滴加澄清石灰水,前者产生白色沉淀,后者无沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜和硝酸反应 | B. | 二氧化碳通入氢氧化钠溶液中 | ||
| C. | 铁和硝酸的反应 | D. | 氯化铝与氨水的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | Zn为正极,Cu为负极 | B. | H+移向负极,SO42-移向正极 | ||
| C. | 电流由Zn极经外电路流向Cu极 | D. | 电子由Zn极经外电路流向Cu极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 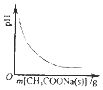 图表示向CH3COOH溶液中逐渐加入CH3COONa固体后,溶液pH的变化 | |
| B. | 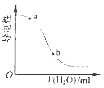 图表示在醋酸溶液中加水时其导电性变化,则CH3COOH溶液的pH:a>b | |
| C. | 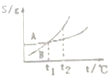 表示A、B两物质的溶解度随温度变化情况,将A、B饱和溶液分别由t1℃升温至t2℃时,溶质的质量分数B=A | |
| D. | 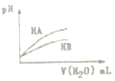 图表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则同浓度的NaA溶液的pH大于NaB溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com