
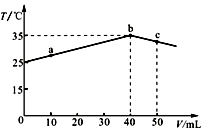
| A. | a→b的过程中,溶液中c(A-)与c(HA)之和始终不变 | |
| B. | b点表示酸碱恰好完全反应 | |
| C. | 等浓度的NaOH和NaA混合溶液中一定存在关系:c(Na+)>c(A-)>c(H+)>c(OH-) | |
| D. | 25℃时,HA的电离平衡常数Ka约为1.23×10-3 |
分析 A.a→b的过程中,一元酸的总物质的量不变,但溶液体积增大;
B.酸碱中和是放热反应,当二者恰好完全中和时溶液温度最高;
C.等浓度的NaOH和NaA混合溶液中NaA水解、NaOH电离导致溶液呈碱性,但其水解程度较小;
D.b点酸碱恰好完全反应,c(HA)=$\frac{40mL×0.1mol/L}{50mL}$=0.08mol/L,Ka=$\frac{c({H}^{+}).c({A}^{-})}{c(HA)}$.
解答 解:A.a→b的过程中,一元酸的总物质的量不变,但溶液体积增大,所以溶液中c(A-)与c(HA)之和减小,故A错误;
B.酸碱中和是放热反应,当二者恰好完全中和时溶液温度最高,所以b点表示酸碱恰好完全反应,故B正确;
C.等浓度的NaOH和NaA混合溶液中NaA水解、NaOH电离导致溶液呈碱性,但其水解程度较小,所以离子浓度大小顺序是c(Na+)>c(OH-)>c(A-)>c(H+),
故C错误;
D.b点酸碱恰好完全反应,c(HA)=$\frac{40mL×0.1mol/L}{50mL}$=0.08mol/L,Ka=$\frac{c({H}^{+}).c({A}^{-})}{c(HA)}$=$\frac{0.01×0.01}{0.08-0.01}$=1.43×10-3,故D错误;
故选B.
点评 本题考查酸碱混合的定性判断,题目难度中等,试题侧重考查学生的分析、理解问题的能力及计算能力,正确分析图象曲线变化为解答根据,注意掌握酸碱混合定性判断的方法.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:推断题
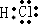 ,X2Y的结构式
,X2Y的结构式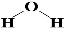 .
.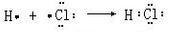 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
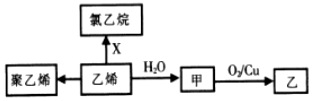
| A. | 1mol聚乙烯含有的原子数目为6NA | B. | CH3OCH3与甲互为同分异构体 | ||
| C. | X为C12 | D. | 甲→乙反应类型为取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | ①中物质 | ②中物质 | 预测②中的现象 |
| A. | 稀盐酸 | 碳酸钠与氢氧化钠的混合溶液 | 立即产生气泡 |
| B. | 浓硝酸 | 用砂纸打磨过的铝条 | 产生红棕色气体 |
| C. | 氯化铝溶液 | 浓氢氧化钠溶液 | 产生大量白色沉淀 |
| D. | 亚硫酸钠溶液 | 高锰酸钾酸性溶液 | 溶液逐渐褪色 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验编号 | 滴入NaOH(aq)的体积/mL | 溶液的pH | |
| HX | HY | ||
| ① | 0 | 3 | m |
| ② | 10.00 | x | y |
| ③ | 20.00 | n | 7 |
| A. | 相同温度下.同浓度的两种酸溶液的导电能力:HX<HY | |
| B. | 表中x<7 | |
| C. | HX和HY的混合溶液中存在:c(H+)=c(X-)+c(Y-)+c(OH-) | |
| D. | 实验②NaOH与HY反应后的溶液中:c(Na+)>c(Y-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| NaCl浓度(g.L-1) 温度(℃) | 20 | 40 | 60 | 100 | 180 | 260 | 300 |
| 13 | 3 | 1 | 0 | 0 | 3 | 9 | 13 |
| 50 | 8 | 4 | 3 | 5 | 10 | 21 | 35 |
| 100 | 17 | 11 | 12 | 15 | 30 | 65 | 95 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸的水溶液呈酸性,故酸性水溶液一定是酸的水溶液 | |
| B. | Fe3O4可写成FeO?Fe2O3;Pb3O4也可写成PbO?Pb2O3 | |
| C. | 工业上通过电解熔融MgCl2来制取金属镁;也可以通过电解熔融AlCl3来制取金属铝 | |
| D. | 第2周期元素氢化物稳定性顺序是HF>H2O>NH3;则第3周期元素氢化物稳定性顺序是HCl>H2S>PH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 草酸二酯的分子中所有碳原子一定共平面 | |
| B. | 草酸二酯水解后生成醇的分子式为C5H12O | |
| C. | 草酸二酯中苯环上氢原子被一个溴原子取代的有机产物有两种 | |
| D. | 1 mol草酸二酯与足量NaOH溶液反应最多消耗4 mol NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
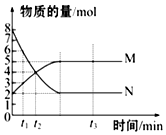 一定温度下,在容积为VL的密闭容器里进行反应:aN(g)?bM(g),M、N的物质的量随时间的变化曲线如图所示:
一定温度下,在容积为VL的密闭容器里进行反应:aN(g)?bM(g),M、N的物质的量随时间的变化曲线如图所示:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com