
分析 (1)化学平衡常数,是指在一定温度下,可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,注意固体、纯液体浓度为常数,不用写固体、纯液体的浓度;
(2)对于放热反应,反应热△H<0;该反应为放热反应,升高温度平衡逆反应进行,化学平衡常数减小;
(3)增大压强平衡向气体体积减小的方向移动;碳是固体,增大碳的用量,不影响反应速率;
(4)根据速率之比等于化学计量数之比计算.
解答 解:(1)可逆反应3SiO2(s)+6C(s)+2N2(g)?Si3N4(s)+6CO(g)的平衡常数K=$\frac{{c}^{6}(CO)}{{c}^{2}({N}_{2})}$;
故答案为:$\frac{{c}^{6}(CO)}{{c}^{2}({N}_{2})}$;
(2)对于放热反应,反应热△H<0;该反应为放热反应,升高温度平衡逆反应进行,化学平衡常数减小;
故答案为:<;减小;
(3)该反应正反应是气体体积增大的反应,增大压强平衡向气体体积减小的方向移动,即向逆反应移动;
碳是固体,增大碳的用量,不影响反应速率,平衡不移动;
故答案为:逆;不移动;
(4)已知CO生成速率为v(CO)=18mol/(L•min),根据速率之比等于化学计量数之比,则N2消耗速率为v(N2)=$\frac{1}{3}$v(CO)=$\frac{1}{3}$×18mol/(L•min)=6mol/(L•min);
故答案为:6mol/(L•min).
点评 本题考查化学平衡常数与影响因素、影响平衡移动的因素、化学反应速率计算等,比较基础,注意方程式中物质的状态,注意基础知识的掌握.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:实验题
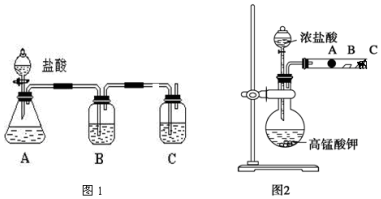
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
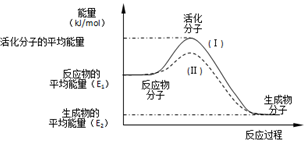 在化学反应中,只有极少数分子的能量比所有分子的平均能量高得多,只有这些高能量的分子发生碰撞时才可能发生化学反应,人们把这些高能量的分子称为活化分子,其他分子成为普通分子.把活化分子的平均能量与反应物分子的平均能量之间的差值叫活化能,单位为kJ/mol.请认真观察如图后回答问题.
在化学反应中,只有极少数分子的能量比所有分子的平均能量高得多,只有这些高能量的分子发生碰撞时才可能发生化学反应,人们把这些高能量的分子称为活化分子,其他分子成为普通分子.把活化分子的平均能量与反应物分子的平均能量之间的差值叫活化能,单位为kJ/mol.请认真观察如图后回答问题.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
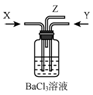 浓硫酸共热产生的气体X和铜和浓硝酸反应产生的气体Y间时通入盛有足量氯化钡溶液的气瓶中(如图装置),下列有关说法不正确的是( )
浓硫酸共热产生的气体X和铜和浓硝酸反应产生的气体Y间时通入盛有足量氯化钡溶液的气瓶中(如图装置),下列有关说法不正确的是( )| A. | 洗气瓶中产生的沉淀是碳酸钡 | B. | 洗气瓶中产生的沉淀是亚硫酸钡 | ||
| C. | 洗气瓶中有氧化还原反应发生 | D. | 在Z导管口有红棕色气体出现 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲为铁锈 | B. | 乙为FeO | C. | 丙为NO2 | D. | 丁为CuCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑤⑦ | B. | ⑤②①③⑥ | C. | ⑤②①④⑦ | D. | ①②⑤③⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 烷烃的同系物可用通式CnH2n+2表示 | |
| B. | 同系物的化学性质相似 | |
| C. | 同系物的物理性质相同 | |
| D. | 同分异构体的化学性质一定不相似 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X的液态单质可在医疗上用于冷冻麻醉 | |
| B. | Y、M两元素气态氢化物的稳定性:Y<M | |
| C. | 工业上制备Z的单质可电解其熔融态的氧化物 | |
| D. | 氧化物XO2与MO2均具有漂白性,且漂白原理相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
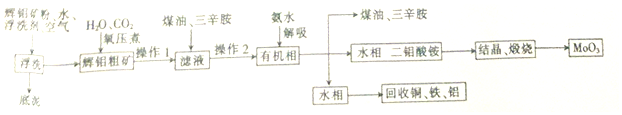
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com