
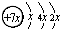 ,E的价层电子排布式为3d64s2.回答下列问题:
,E的价层电子排布式为3d64s2.回答下列问题: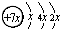 ,x=2,应为Si元素,E的价层电子排布式为3d64s2,原子序数为26,应为Fe元素,A、D同主族,则D为P元素,结合对应单质、化合物的性质以及元素周期律的递变规律解答该题.
,x=2,应为Si元素,E的价层电子排布式为3d64s2,原子序数为26,应为Fe元素,A、D同主族,则D为P元素,结合对应单质、化合物的性质以及元素周期律的递变规律解答该题.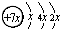 ,x=2,应为Si元素,E的价层电子排布式为3d64s2,原子序数为26,应为Fe元素,A、D同主族,则D为P元素,
,x=2,应为Si元素,E的价层电子排布式为3d64s2,原子序数为26,应为Fe元素,A、D同主族,则D为P元素,

 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:
容器温度 浓度 |
a容器 400℃ |
b容器 425℃ |
c容器 450℃ |
d容器 475℃ |
e容器 500℃ |
| c(O2) | 0.8 | 0.6 | 0.3 | 0.5 | 0.7 |
| c(SO3) | 0.4 | 0.8 | 1.4 | 1.0 | 0.6 |

| c2(SO3) |
| c2(SO2)×c(O2) |
| c2(SO3) |
| c2(SO2)×c(O2) |


查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:



| ①O3 | ②Zn,H2O |




查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com