
分析 晶体应该放在研钵中研细,然后放在坩埚中加热,直到前后两次称量的质量差不超过0.001g后停止加热,说明完全失水,因为硫酸铜易吸收空气中的水蒸气,所以放在干燥器中冷却,据此分析.
解答 解:测定硫酸铜晶体(CuSO4•xH2O)中结晶水含量的原理为先将晶体放在研钵中研细,然后放在坩埚中加热,直到前后两次称量的质量差不超过0.001g后停止加热,说明完全失水,再放在干燥器中冷却,最后利用加热前后的质量差来计算结晶水含量,
故答案为:研钵;坩埚;干燥器;前后两次称量的质量差不超过0.001g.
点评 本题既考查了学生对化学实验的基本操作和常见仪器的认识和使用,又考查了学生分析问题和解决问题的能力,只要学生认真的去操作过、体验过、思考过,就会觉得很熟悉、很简单.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
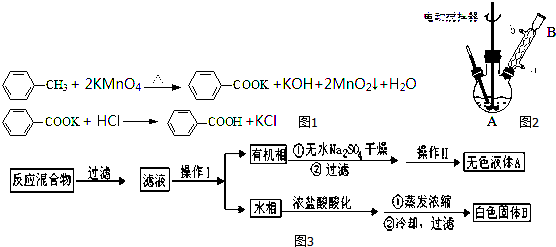
 实验室用NaBr、浓H2SO4、乙醇为原料,制备溴乙烷,反应的化学方程式为:
实验室用NaBr、浓H2SO4、乙醇为原料,制备溴乙烷,反应的化学方程式为:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(A)=0.5 mol•L-1•s-1 | B. | v(B)=0.5 mol•L-1•s-1 | ||
| C. | v(C)=1.8 mol•L-1•min-1 | D. | v(D)=1 mol•L-1•s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①和② | B. | ①和③ | C. | ②和③ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加热、冷却、称量,重复两次即是恒重操作 | |
| B. | 瓷坩埚加热后冷却时,必须放在干燥器中 | |
| C. | 加热晶体时先用小火,后渐改为用大火加热 | |
| D. | 加热时如晶体爆溅出坩埚,应再加一些晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
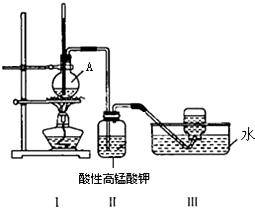 某学习小组在实验室里用乙醇与浓硫酸混合加热制乙烯,并进行有关乙烯性质的探究.装置如图.请帮助回答下列问题:
某学习小组在实验室里用乙醇与浓硫酸混合加热制乙烯,并进行有关乙烯性质的探究.装置如图.请帮助回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com