
试写出联氨和四氧化二氮反应的化学方程式,并标出该反应中电子转移的方向和数目:________________________。
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源:物理教研室 题型:022
(1)写出肼的电子式__________。
(2)古典Resching法制备肼的化学方程式:______________________。
(3)肼燃烧的热化学方程式:_____________________。
查看答案和解析>>
科目:高中化学 来源:2004全国各省市高考模拟试题汇编·化学 题型:043
发射航天器的火箭可用肼做燃料.肼又叫联氨,其分子式为(NH2)2,为无色可燃性液体,熔点275K,沸点386.5K,1克肼燃烧时放出19.5kJ的热量(通常状况下测定),是一种清洁的能源物质.古典的Rasching法制备肼是以次氨酸钠和足量的氨反应,获得肼的稀溶液,经分析确定该溶液中含有氯离子.回答下列问题:
(1)写出肼的电子式________
(2)古典Rasching法制备肼的化学方程式
________
(3)肼燃烧的热化学方程式________
查看答案和解析>>
科目:高中化学 来源:通州市2006—2007学年(上)高三期中调研测试、化学试卷 题型:022
| |||||||||||||||||||||||||
查看答案和解析>>
科目:高中化学 来源:北京模拟题 题型:填空题
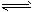 1/2N2O4(g) △H=- 26. 35 kJ/mol
1/2N2O4(g) △H=- 26. 35 kJ/mol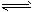 1/2N2O4(g)的影响如图所示。
1/2N2O4(g)的影响如图所示。 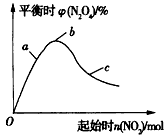
①在图中用虚线画出400℃时对应的图象;
②a、b、c三点中,NO2的转化率最高的是____(填字母)。
(4)N2H4能使锅炉内壁的铁锈(主要成分为Fe2O3)变成磁性氧化铁(Fe3O4)层,从而减缓锅炉锈蚀。若反 应过程中联氨转化为氮气,则每生成1 mol Fe3O4,转移电子的物质的量为_______________。
(5)联氨-空气燃料电池是一种碱性电池,电解质溶液是20% ~30%的氢氧化钾溶液。该电池放电时,负极的反应式为______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com