
【题目】某同学按照课本实验要求,用50 mL 0.50 mol/L的盐酸与50 mL 0.55 mol/L的NaOH 溶液在图所示的装置中进行中和反应。通过测定反应过程中所放出的热量计算中和热。下列说法正确的是( )
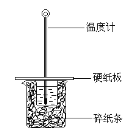
A. 实验过程中没有热量损失
B. 烧杯间填满碎纸条的作用是固定小烧杯
C. 图中实验装置缺少环形玻璃搅拌棒
D. 若将盐酸体积改为60 mL,理论上所求中和热不相等
 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案科目:高中化学 来源: 题型:
【题目】室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:
实验编号 | 起始浓度/(mol·L-1) | 反应后溶液的pH | |
c(HA) | c(KOH) | ||
① | 0.1 | 0.1 | 9 |
② | x | 0.2 | 7 |
下列判断不正确的是
A.实验①反应后的溶液中:c(K+)>c(A-)>c(OH-)>c(H+)
B.实验①反应后的溶液中:c(OH-)=c(K+)-c(A-)=![]() mol/L
mol/L
C.实验②反应后的溶液中:c(A-)+c(HA)>0.1mol·L-1
D.实验②反应后的溶液中:c(K+)=c(A-)>c(OH-) =c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将Na、Mg、Al各0.3mol分别放入足量的HCl中,同温同压下产生的气体的体积比是( )
A. 1 : 2 : 3 B. 6 : 3 : 2 C. 3 : 1 : 1 D. 1 : 1 : 1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一容积不变的密闭容器中充入一定量A(g)和B,发生反应:xA(g)+2B(s) ![]() yC(g) △H<0.在一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如图所示。
yC(g) △H<0.在一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如图所示。

请回答下列问题
(1)根据图示可确定x:y=________。
(2)0-10min容器内压强______ (填“变大”、“ 不变”或“变小”)
(3)推测第10min引起曲线变化的反应条件可能是______(填编号,下同);第16min引起曲线变化的反应条件可能是________。
①减压 ② 增大A的浓度 ③增大C的量 ④升温 ⑤ 降温⑥ 加催化剂
(4)若平衡1的平衡常数为K1,平衡II的平衡常数为K2,则K1______(填“>”“=”或“<”)K2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)浙江大学用甲醇、CO、O2在常压、某温度和催化剂的条件下合成碳酸二甲酯(CH3OCOOCH3)的研究开发。已知:
①1mol CO完全燃烧放出283.0kJ的热量;
②1mol H2O(l)完全蒸发变成H2O(g)需吸收44.0 kJ的热量;
③2CH3OH(g)+CO2(g) ![]() CH3OCOOCH3(g)+H2O(g) ΔH=-15.5 kJ·mol-1
CH3OCOOCH3(g)+H2O(g) ΔH=-15.5 kJ·mol-1
则2CH3OH(g)+CO(g)+1/2O2(g)![]() CH3OCOOCH3(g)+H2O(l) ΔH=__________。
CH3OCOOCH3(g)+H2O(l) ΔH=__________。
(2)工业合成氨的反应为N2(g)+3H2(g)![]() 2NH3(g)是一个放热的可逆反应,反应条件是高温、高压并且需要合适的催化剂。已知形成1mol H—H键、1mol N—H键、1mol N≡N键放出的能量分别为436 kJ、391 kJ、946 kJ。则:
2NH3(g)是一个放热的可逆反应,反应条件是高温、高压并且需要合适的催化剂。已知形成1mol H—H键、1mol N—H键、1mol N≡N键放出的能量分别为436 kJ、391 kJ、946 kJ。则:
①若1 mol氮气完全反应生成氨气可放出的能量为__________kJ。
②如果将1 mol氮气和3 mol氢气混合,使充分反应,反应放出的能量总小于上述数值,为什么?__________。
③实验室模拟工业合成氨时,在容积为2L的密闭容器内,反应经过10分钟后,生成10 mol 氨气,则用氮气表示的化学反应速率是__________mol·L-1·min-1。
④一定条件下,当合成氨的反应达到化学平衡时,下列说法正确的是__________。
a.以同一物质表示的正反应速率和逆反应速率相等
b.正反应速率最大,逆反应速率为0
c.氮气的转化率达到最大值
d.氮气和氢气的浓度相等
e.N2、H2和NH3的体积分数相等
f.反应达到最大限度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求完成下列各小题
(1)25°C时,0.1 mol·L-1NH4Cl溶液的pH____7(填“<”、“=”或“>”),其原因是_________(用离子方程式表示);
(2)下列物质能导电且属于电解质的是________(填序号)。
A.铁 B.盐酸 C.氯化钠晶体 D.熔融氢氧化钠
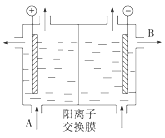
(3)可用阳离子交换膜法电解饱和食盐水制NaOH,其工作原理如下图所示。
①请写出A、B两处物质的名称:A_______________,B__________________。
②请写出电解食盐水的离子方程式__________________________________________。
(4)合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如下:
温 度(℃) | 360 | 440 | 520 |
K值 | 0.036 | 0.010 | 0.0038 |
若25℃时1摩尔氮气完全转化为氨气放出92.4KJ的热量,写出工业合成氨的热化学方程式____________。
(5)合成氨的原料气H2还可通过反应CO(g) + H2O(g)![]() CO2 (g) + H2(g) 获取。
CO2 (g) + H2(g) 获取。
①T ℃时,向容积固定为5 L的容器中充入1 mol水蒸气和1 mol CO,反应达平衡后,测得CO的浓度为0.08 mol·L-1,则平衡时CO的转化率为_______,该温度下反应的平衡常数K值为_________。
②保持温度仍为T ℃,只改变水蒸气和CO的初始物质的量之比,充入该容器进行反应,下列描述能够说明体系处于平衡状态的是_____________(填序号)。
a.容器内压强不随时间改变
b.混合气体的密度不随时间改变
c.单位时间内生成a mol CO2的同时消耗a mol H2
d.混合气中n(CO) : n(H2O) : n(CO2) : n(H2) = 1: 16 : 6 : 6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用化学原理和相应的方程式解释生活中的现象。
(1) 碳酸钙高温分解生成氧化钙和二氧化碳的化学反应中,![]() S______0;
S______0;
(2)明矾水溶液的pH_______7, 请用离子方程式说明原因______;
(3)盐碱地(含有氯化钠,碳酸钠)不利于作物生长。通过施加适量石膏可以降低土壤碱性。试用水解方程式分别表示盐碱地产生碱性的原因______________;以及用石膏降低其碱性的反应原理______________;
(4)请写出硫酸钡的溶解平衡方程式______________;并说明为什么在洗涤硫酸钡沉淀时,采用0.010mol/L的硫酸进行洗涤______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图像与对应叙述相符合的是

A. 图甲表示某可逆反应物质的浓度随时间的变化,且在t时刻达到平衡状态
B. 图乙表示向CH3COOH溶液中通入NH3至过量的过程中溶液导电性的变化
C. 图丙表明合成氨反应时放热反应,b表示在反应体系中加入了催化剂
D. 图丁表示向CH3COOH溶液中逐渐加入CH3COONa固体后,溶液pH的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,在容积为2L的密闭容器中,将2 mol 气体M和3 mol N气体混合,发生如下反应:2M(g) + 3N(g) ![]() x Q(g) +3R(g),该反应达平衡时,生成2.4mol R,并测得Q的浓度为0.4 mol/L,下列有关叙述正确的是
x Q(g) +3R(g),该反应达平衡时,生成2.4mol R,并测得Q的浓度为0.4 mol/L,下列有关叙述正确的是
A. x值为2 B. 混合气体的密度增大
C. N的转化率为20% D. 平衡时N的浓度为0.3 mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com