

 (填结构简式);
(填结构简式);分析 有结构模型可知A为甲烷,B为乙烷,C为乙烯,D为苯,E为丙烷,根据物质的组成、结构和性质解答该题.
(1)常温下,分子中含有碳原子个数不大于4的烃为气态烃,根据其球棍模型判断,分子中含有碳氢原子个数比最大即为含碳量最高的.
(2)含有碳碳双键或三键或苯环的烃能发生加成反应.
(3)根据同系物的概念:结构相似,分子组成相差整数倍个CH2的有机物来回答;
(4)乙烯中含有双键,可以和溴水之间发生加成反应;
(5)苯和溴水混合,苯在溴水中的溶解度大于水中的溶解度.
解答 解:有结构模型可知A为甲烷,B为乙烷,C为乙烯,D为苯,E为丙烷,
(1)常温下,分子中含有碳原子个数不大于4的烃为气态烃,根据其球棍模型判断,分子中含有碳氢原子个数比最大即为含碳量最高的,所以含碳量最大的是苯,
故答案为: ;
;
(2)含有碳碳双键或三键或苯环的烃能发生加成反应,所以乙烯、乙炔、能发生加成反应,故答案为:CD;
(3)A为甲烷,B为乙烷,E为丙烷结构相似,分子组成相差整数倍个CH2,互为同系物,故答案为:CH4、CH3CH3、CH3CH2CH3;
(4)乙烯中含有双键,可以和溴水之间发生加成反应,与溴水反应的化学方程式为:CH2═CH2+Br2→CH2BrCH2Br,
故答案为:CH2═CH2+Br2→CH2BrCH2Br;
(5)苯在溴水中的溶解度大于水中的溶解度,苯和溴水混合并充分振荡、静置后的现象:分层,上层呈现橙红色,下层无色,故答案为:分层,上层呈现橙红色,下层无色.
点评 本题考查有机物的结构和性质,题目难度不大,注意把握有机物的结构特点,根据结构模型判断有机物的种类,为解答该题的关键.


科目:高中化学 来源: 题型:选择题
| A. | 4 mol | B. | 3.4 mol | C. | 2.8 mol | D. | 1.2 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
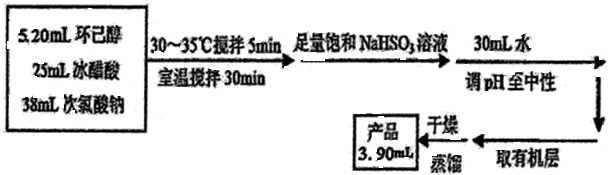
 环己酮是重要化工原料,是制造尼龙、己内酰胺和己二酸的主要中间体.某化学兴趣小组尝试用次氯酸钠制备环己酮.方程式为:
环己酮是重要化工原料,是制造尼龙、己内酰胺和己二酸的主要中间体.某化学兴趣小组尝试用次氯酸钠制备环己酮.方程式为: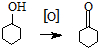
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 操作及现象 | 结论 | |
| A | 某溶液中加入氯化钡溶液,产生白色沉淀,再加入稀硝酸沉淀不溶解 | 溶液中一定含有SO42- |
| B | 某溶液中加入硝酸银溶液,产生白色沉淀 | 溶液中一定含有Cl- |
| C | 用洁净铂丝蘸取某溶液在火焰上灼烧,火焰呈黄色 | 溶液中有Na+,无K+ |
| D | 向某溶液中先加几滴KSCN溶液,无明显现象,再滴氯水,溶液变红 | 溶液中一定含有Fe2+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第一电离能Y小于X | |
| B. | 最高价含氧酸的酸性:X对应的酸的酸性强于Y | |
| C. | 气态氢化物的稳定性:HmY强于HnX | |
| D. | X和Y形成化合物时,X显负价,Y显正价 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠是淡黄色固体 | |
| B. | 钠的密度:小于煤油大于水 | |
| C. | 钠在化学反应中只能做还原剂 | |
| D. | 钠与硫酸铜溶液反应有红色的铜生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2Na+2H2O=2NaOH+H2↑ | B. | Cl2+H2O═HCl+HClO | ||
| C. | 2H2O═2H2↑+O2↑ | D. | Na2O+H2O═2NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | A极为负极,Cu为阳极 | |
| B. | 左烧杯溶液和右烧杯溶液的pH都变小 | |
| C. | 左烧杯Pt极和右烧杯Fe极的电解产物物质的量之比为1:1 | |
| D. | 左烧杯溶液浓度变大,右烧杯溶液浓度不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com