
【题目】设NA为阿伏伽德罗常数的值,下列叙述正确的是( )
A. 11gT2O含有的电子数为5NA
B. 常温下,0.2L 0.5molL﹣1NH4NO3溶液的氮原子数小于0.2NA
C. 含4molHCl的浓盐酸与足量二氧化锰反应转移的电子总数为NA
D. 标准状况下,2.24L H2S全部溶于水所得溶液中HS﹣和S2﹣离子数之和为0.1NA
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】25℃时,将浓度均为0 1mol·L-1、体积分别为V a和Vb的HA 溶液与BOH 溶液按不同体积比混合,保持Va+Vb=100mL,Va、Vb与混合液的pH 的关系如图所示。下列说法正确的是

A. a→c过程中水的电离程度始终增大
B. b点时,c(B+)=c(A+)=c(H+)=c(OH-)
C. c 点时, 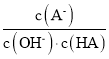 随温度升高而减小
随温度升高而减小
D. 相同温度下,Ka (HA)>Kb(BOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是某化学兴趣小组的同学学习元素周期律时设计的两套实验方案.
(1)【实验一】实验步骤如下:
实验序号 | 实验步骤 |
① | 向新制的Na2S溶液中滴加新制的氯水 |
② | 将镁条投入1mol/L的稀盐酸中 |
③ | 将铝条投入1mol/L的稀盐酸中 |
(i)设计该实验方案的目的是:探究同周期元素的 .
(ii)实验①的现象是 ,反应的化学方程式是 .
(2)【实验二】为验证Cl2、Br2的非金属性强弱,设计了如下实验:(可供选择的试剂有:氯水、溴水、NaCl溶液、NaBr溶液、酒精、四氯化碳)实验步骤如图.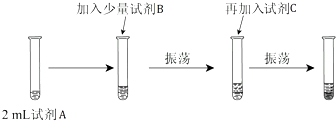
(iii)试剂A是 ;试剂B是 ;试剂C是 .
(iv)试剂C在实验中所起的作用是 ,
加入C振荡、静置后看到的现象是: .
以上反应可以证明Cl2的非金属性 (填“强于”或“弱于”)Br2的非金属性,反应的离子方程式为: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,向1L密闭容器中加入1mol HI(g),发生反应2HI(g)H2(g)+I2(g),2s时生成0.1mol H2 , 则以HI表示该时段的化学反应速率是( )
A.0.05 molLˉ1sˉ1
B.0.1 molLˉ1sˉ1
C.0.2 molLˉ1sˉ1
D.0.8 molLˉ1sˉ1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于卤素及其化合物的叙述错误的是 ( )
A. 非金属性:F>Cl>Br>I
B. 单质氧化性:F2>Cl2>Br2>I2
C. 氢化物稳定性:HF>HCl>HBr>HI
D. 沸点:F2>Cl2>Br2>I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下题;
(1)下列原子: ![]() C、
C、 ![]() N、
N、 ![]() Na、
Na、 ![]() H、
H、 ![]() U、
U、 ![]() K、
K、 ![]() U中共有种元素,种核素,互为同位素.
U中共有种元素,种核素,互为同位素.
(2)阴离子的中子数为N:AXn﹣共有x个电子,则N= .
(3)书写电子式 HClONaCl .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W的原子序数依次增大,X原子在元素周期表中原子半径最小,Y的次外层电子数是最外层的![]() ,ZX2是一种储氢材料,W与Y属于同一主族。下列叙述正确的是:
,ZX2是一种储氢材料,W与Y属于同一主族。下列叙述正确的是:
A. 原子半径:rW>rZ>rY
B. 化合物X2Y、ZY、ZX2中化学键的类型相同
C. 由X、Y、Z、W组成的化合物的水溶液可能显酸性
D. 由Y元素形成的离子与W元素形成的离子的电子数不可能相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com