
| A. | ①③ | B. | ③⑤ | C. | ①②⑤ | D. | ①③⑤ |
分析 硝酸、硫酸的浓度不同,性质不同,与金属发生反应时,发生不同的氧化还原反应,以此解答该题.
解答 解:①Cu与HNO3溶液中,若为浓硝酸,发生Cu+4HNO3═Cu(NO3)2+2NO2↑+2H2O,若为稀硝酸,则发生3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O,故正确;
②Cu与FeCl3溶液中,无论浓度大小都只发生Cu+2FeCl3═2FeCl2+CuCl2,故错误;
③Zn与H2SO4溶液中,若为稀硫酸,发生Zn+H2SO4═ZnSO4+H2↑,若为浓硫酸,则发生Zn+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ZnSO4+SO2↑+2H2O,故正确;
④Fe与HCl溶液中,无论浓度大小都只发生Fe+2HCl=FeCl2+H2↑,故错误.
⑤Na和O2加热生成过氧化钠,不加热生成氧化钠,所以受温度的影响,故错误;
故选A.
点评 本题考查常见物质的性质,明确浓稀硝酸、浓硫酸具有强氧化性及发生的化学反应是解答本题的关键,注意相关方程式的书写,难度中等.


科目:高中化学 来源: 题型:推断题
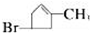 .化合物A~H的转化关系如图所示,B1和B2互为同分异构体,B1的摩尔质量80g/mol;G1和G2互为同分异构体,核磁共振氢谱显示二者均只有两种氢,G1无甲基.请完成下列问题.
.化合物A~H的转化关系如图所示,B1和B2互为同分异构体,B1的摩尔质量80g/mol;G1和G2互为同分异构体,核磁共振氢谱显示二者均只有两种氢,G1无甲基.请完成下列问题.
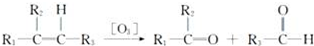
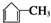 ,G2所含官能团为醛基、羰基.
,G2所含官能团为醛基、羰基.
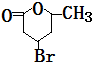 +H2O.
+H2O.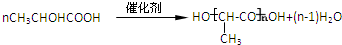 .
.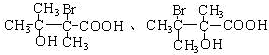 任意一种.
任意一种.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作及现象 | 实验结论 |
| A | 向Fe(NO3)3溶液中通入SO2,滴加BaCl2溶液; 产生白色沉淀 | NO3-在酸性条件下能氧化SO2生成SO42- |
| B | 向Fe(NO3)2溶液中滴加少量盐酸; 浅绿色变深绿色 | 溶液中存在Fe2+水解平衡移动 |
| C | 向沸水中滴加FeCl3饱和溶液,煮沸得红褐色液体;用激光灯照射液体,有一条明亮“通路” | 该液体分散质直径介于1nm与100nm之间 |
| D | 向FeI2溶液中滴加酸化的双氧水和淀粉溶液;溶液为蓝色 | Fe2+的还原性比I-的还原性弱 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两原子N层上都有1个s电子,一个原子有d电子,另一个原子无d电子 | |
| B. | 最外层电子排布为2s22p6的原子和最外层电子排布为2s22p6的离子 | |
| C. | 原子核外M层上的s、p轨道都充满电子,而d轨道上没有电子的两种原子 | |
| D. | 两原子的核外全部都是s电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 汽车尾气、工业废气的排放是形成“雾霾”的主要原因 | |
| B. | 用铝制容器盛放浓硫酸,是因为铝和浓硫酸不反应 | |
| C. | 不锈钢比普通钢抗腐蚀能力强,是因为表面镀了一层铬 | |
| D. | “辽宁舰”用于舰载机降落阻拦索的是一种特种钢缆,属于新型无机非金属材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
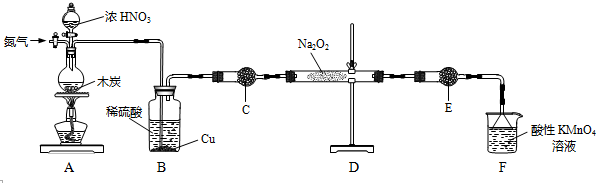
| 滴定次数 | 1 | 2 | 3 | 4 |
| KMnO4溶液体积/mL | 20.60 | 20.02 | 20.00 | 19.98 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 按系统命名法,有机物 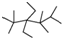 的命名为2,3,3,5,5五甲基-4,4-二乙基己烷 的命名为2,3,3,5,5五甲基-4,4-二乙基己烷 | |
| B. |  主链上的碳原子数是5 主链上的碳原子数是5 | |
| C. | 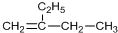 加氢后可以得到3-甲基戊烷 加氢后可以得到3-甲基戊烷 | |
| D. |  的名称是1,3,4-三甲基苯 的名称是1,3,4-三甲基苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
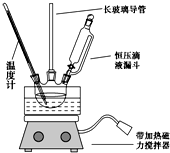 硝基苯是重要的精细化工原料,是医药和染料的中间体,还可作有机溶剂.
硝基苯是重要的精细化工原料,是医药和染料的中间体,还可作有机溶剂. HNO3(浓)$→_{98%浓H_{2}SO_{4}}^{50~60℃}$
HNO3(浓)$→_{98%浓H_{2}SO_{4}}^{50~60℃}$ +H2O
+H2O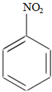 +HNO3(浓)$→_{98%浓H_{2}SO_{4}}^{95℃}$
+HNO3(浓)$→_{98%浓H_{2}SO_{4}}^{95℃}$ +
+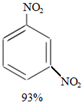 +
+
| 物质 | 熔点/℃ | 沸点/℃ | 密度(20℃) | 溶解性 |
| 苯 | 5.5 | 80 | 0.88 | 微溶于水 |
| 硝基苯 | 5.7 | 210.9 | 1.205 | 难溶于水 |
| 1,3二硝基苯 | 89 | 301 | 1.57 | 微溶于水 |
| 浓硝酸[来] | - | 83 | 1.4 | 易溶于水 |
| 浓硫酸 | - | 338 | 1.84 | 易溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X、Y、Z、W四种元素形成的化合物,其水溶液一定显强酸性 | |
| B. | Y、W的氢化物的稳定性后者强于前者 | |
| C. | X、Y、Z、W形成的简单离子半径大小依次增大 | |
| D. | Z的单质可与X、Y形成的共价化合物反应生成X2单质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com