
分析 (1)①2NH3(g)+CO2(g)?NH2CO2NH4(s);△H1
②NH2CO2NH4(s)?CO(NH2)2(s)+H2O(l);△H2
③2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g);△H3
④H2O(g)?H2O(l);△H4
由盖斯定律①=③+④-②可得;
(2)反应Ⅱ:NH2COONH4(s)?CO(NH2)2(s)+H2O(g)是气体体积增大的反应,熵变△S>0;
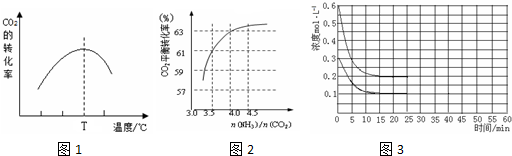
(3)①温度高于T℃时,因为反应Ⅲ为自发反应,△S<0,则反应△H3<0,是放热反应,温度升高平衡向逆方向进行,CO2的平衡转化率降低;
②氨气量增大对二氧化碳的转化率增加不大;
(4)①由图可知,15min时达平衡,NH3的浓度变化量为0.6mol/L-0.2mol/L=0.4mol/L,根据v=$\frac{△c}{△t}$计算;由图象可知NH3和CO2的起始浓度分别为0.6mol/L、0.3mol/L,平衡时NH3和CO2的浓度分别为0.2mol/L、0.1mol/L,代入化学平衡常数K计算;
②根据等效平衡知识来作图,25min时再向容器中充入2mol氨气和1mol二氧化碳,在40min时重新达到平衡,则建立的是等效平衡,二氧化碳的平衡浓度保持不变.
解答 解:(1)①2NH3(g)+CO2(g)?NH2CO2NH4(s);△H1
②NH2CO2NH4(s)?CO(NH2)2(s)+H2O(l);△H2
③2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g);△H3
④H2O(g)?H2O(l);△H4
由盖斯定律可知①=③+④-②,则△H1=△H3+△H4-△H2;
故答案为:△H3+△H4-△H2;
(2)反应Ⅱ:NH2COONH4(s)?CO(NH2)2(s)+H2O(g)是气体体积增大的反应,熵变△S>0;
故答案为:>;
(3)①温度高于T℃时,因为反应Ⅲ为自发反应,△S<0,则反应△H3<0,是放热反应,温度升高平衡向逆方向进行,CO2的平衡转化率降低;
故答案为:温度高于T℃时,因为反应Ⅲ为自发反应,△S<0,则反应△H3<0,是放热反应,温度升高平衡向逆方向进行,CO2的平衡转化率降低;
②氨碳比在4.5时,需要氨气较多,但依据图象分析二氧化碳转化率增大不多,工业合成氨生成工艺较复杂,提高生产成本;
故答案为:氨碳比在4.5时,NH3的量增大较多,而CO2的转化率增加不大,提高了生产成本;
(4)①由图可知,15min时达平衡,NH3的浓度变化量为0.6mol/L-0.2mol/L=0.4mol/L,故v(NH3)=$\frac{△c}{△t}$=$\frac{0.4mol/L}{15min}$=0.027mol•L-1•min-1,
反应2NH3(g)+CO2(g)?NH2CO2NH4(s),由图象可知NH3和CO2的起始浓度分别为0.6mol/L、0.3mol/L,平衡时NH3和CO2的浓度分别为0.2mol/L、0.1mol/L,固体浓度视为不变,K=$\frac{1}{c{\;}^{2}(NH{\;}_{3})•c(CO{\;}_{2})}$=$\frac{1}{0.2{\;}^{2}×0.1}$=250;
故答案为:0.027mol•L-1•min-1;250;
②25min时再向容器中充入2mol氨气和1mol二氧化碳,在40min时重新达到平衡,则建立的是等效平衡,二氧化碳的平衡浓度保持不变,曲线如下: ;
;
故答案为: .
.
点评 本题考查反应热的计算、化学反应速率计算、化学平衡的影响因素、化学平衡常数等知识点,题目难度中等,试题综合性较强,侧重考查学生分析计算能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:推断题
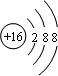 ;A与C组成的化合物为MgS(用具体元素符号表示).
;A与C组成的化合物为MgS(用具体元素符号表示).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲醇被称为21世纪的新型燃料,工业上通过下列反应I和Ⅱ,用CH4和H2O为原料来制备甲醇.
甲醇被称为21世纪的新型燃料,工业上通过下列反应I和Ⅱ,用CH4和H2O为原料来制备甲醇.| 实验编号 | T(℃) | $\frac{n(CO)}{n({H}_{2})}$ | P(MPa) |
| ⅰ | 150 | $\frac{1}{3}$ | 0.1 |
| ⅱ | 150 | $\frac{1}{3}$ | 5 |
| ⅲ | 350 | $\frac{1}{3}$ | 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BaCl2溶液与稀H2SO4溶液的反应:Ba2++2Cl-+2H++SO42-═BaSO4↓+2HCl | |
| B. | NaHCO3与NaOH溶液反应:HCO3-+OH-═CO2↑+H2O | |
| C. | 用KSCN检验Fe3+:Fe3++3SCN-═Fe(SCN)3↓ | |
| D. | 盛放碱性试剂的溶液不能用玻璃塞的原因:SiO2+2OH-═SiO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二者的分子个数之比为16:17 | |
| B. | 二者的原子个数之比为17:16 | |
| C. | 二者的氢原子个数之比为17:12 | |
| D. | 同温同压下两种气体的体积之比为16:17 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 和4He是同一种原子 | B. | 比4He少一个质子 | ||
| C. | 是4He的同位素 | D. | 比4He多一个中子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com