
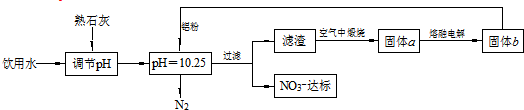
| A. | 该方案在调节pH时,若pH过大或过小都会造成Al的利用率降低 | |
| B. | 在加入铝粉的反应中,氧化产物和还原产物的物质的量之比为10:3 | |
| C. | 用熟石灰调节PH主要原因是价格便宜且引入的Ca2+对人体无毒 | |
| D. | 为了降低能耗,工业上往往用AlCl3代替固体a来制备固体b |
分析 由流程图可知,pH=10.25时,Al和NO3-发生氧化还原反应生成氮气,固体b是Al,电解熔融固体a得到Al,则a是Al2O3,滤渣在空气中煅烧得到Al2O3,则滤渣为Al(OH)3,所以铝粉和硝酸根离子在碱性条件下反应生成氮气和Al(OH)3,其反应方程式为10Al+6NO3-+18H2O=10Al(OH)3+3N2↑+6OH-;
A.Al与酸、碱均反应;
B.结合反应可知,氧化产物为Al(OH)3,还原产物为N2;
C.氢氧化钙可中和氢离子,对该流程无影响;
D.氯化铝为共价化合物,电解时不导电.
解答 解:由流程图可知,pH=10.25时,Al和NO3-发生氧化还原反应生成氮气,固体b是Al,电解熔融固体a得到Al,则a是Al2O3,滤渣在空气中煅烧得到Al2O3,则滤渣为Al(OH)3,所以铝粉和硝酸根离子在碱性条件下反应生成氮气和Al(OH)3,其反应方程式为10Al+6NO3-+18H2O=10Al(OH)3+3N2↑+6OH-;
A.Al与酸、碱均反应,则若pH过大或过小都会造成Al的利用率降低,故A正确;
B.10Al+6NO3-+18H2O=10Al(OH)3+3N2↑+6OH-中氧化产物为Al(OH)3,还原产物为N2,氧化产物和还原产物的物质的量之比为10:3,故B正确;
C.氢氧化钙可中和氢离子,对该流程无影响,则用熟石灰调节PH主要原因是价格便宜且引入的Ca2+对人体无害,故C正确;
D.氯化铝为共价化合物,电解时不导电,则不能利用氯化铝代替氧化铝,故D错误;
故选D.
点评 本题考查混合物分离提纯,为高频考点,把握流程中的反应及混合物分离提纯方法为解答的关键,侧重分析与应用能力的考查,注意发生的氧化还原反应,题目难度不大.


科目:高中化学 来源: 题型:解答题




查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如表是A、B、C三种烃的有关信息;
如表是A、B、C三种烃的有关信息;| A | B | C |
| ①能使溴的四氯化碳溶液褪色; ②比例模型为:  | 1棍模型为: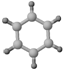 ②平面型结构 | ①能使溴的四氯化碳溶液褪色; ②比例模型为:  ③能与H2在一定条件下反应生成A |
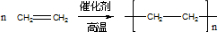 .
. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2的比例模型: | |
| B. | N2H4的电子式为: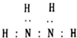 | |
| C. | NaH中氢离子结构示意图为: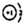 | |
| D. | 质子数是82,中子数是122的铅原子:${\;}_{82}^{122}$Pb |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH3 | B. | CH2═CH2 | C. | CH3CH═CH2 | D. | CH2═CHCH═CH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②③④ | C. | ④⑤⑥ | D. | ②③⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol/L Na2CO3溶液中的Na+数目为2NA | |
| B. | 标准状况下,1 molCH2Cl2所占有的体积约为22.4L | |
| C. | 常温常压下,38g 18OH-中含质子数20NA | |
| D. | 14g C2H4和C3H6的混合气体含有的原子总数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com