
【题目】甲醇既是重要的化工原料,又可作为燃料.利用合成气(主要成分为![]() 、
、![]() 和
和![]() )在催化剂的作用下合成甲醇,发生的主要反应如下:
)在催化剂的作用下合成甲醇,发生的主要反应如下:
①![]()
②![]()
③![]()
回答下列问题:
化学键 |
|
| (CO)中的 |
|
|
|
|
|
|
|
|
(1)已知反应①中的相关的化学键键能数据如下:由此计算![]() ________
________ ![]() .
. ![]() ,已知
,已知![]() .
. ![]() ,则
,则![]() ________
________ ![]() .
. ![]()
(2)反应①的化学平衡常数![]() 的表达式为________;图
的表达式为________;图![]() 中能正确反映平衡常数
中能正确反映平衡常数![]() 随温度变化关系的曲线为________(填曲线标记字母),其判断理由是_____________________________.
随温度变化关系的曲线为________(填曲线标记字母),其判断理由是_____________________________.
(3)合成气的组成![]() 时体系中的
时体系中的![]() 平衡转化率
平衡转化率![]() 与温度和压强的关系如图
与温度和压强的关系如图![]() 所示.
所示. ![]() 值随温度升高而________(填“增大”或“减小”),其原因是_________________.图
值随温度升高而________(填“增大”或“减小”),其原因是_________________.图![]() 中的压强由大到小为________,其判断理由是____________________________________________
中的压强由大到小为________,其判断理由是____________________________________________

【答案】 -99 +41 ![]()
![]() 反应①为放热反应,其平衡常数随温度升高而减小 减小 反应①正反应为放热反应,升高温度,平衡向逆反应方向移动,平衡体系中
反应①为放热反应,其平衡常数随温度升高而减小 减小 反应①正反应为放热反应,升高温度,平衡向逆反应方向移动,平衡体系中![]() 的量增大,反应③为吸热反应,升高温度,平衡向正反应方向移动,又使平衡体系中
的量增大,反应③为吸热反应,升高温度,平衡向正反应方向移动,又使平衡体系中![]() 的增大,总结果,随温度升高,
的增大,总结果,随温度升高, ![]() 的转化率减小
的转化率减小 ![]() 相同温度下,反应③前后气体分子数不变,压强改变不影响其平衡移动,反应①正反应为气体分子数减小的反应,增大压强,有利于平衡向正反应方向移动,
相同温度下,反应③前后气体分子数不变,压强改变不影响其平衡移动,反应①正反应为气体分子数减小的反应,增大压强,有利于平衡向正反应方向移动, ![]() 的转化率增大,故增大压强有利于
的转化率增大,故增大压强有利于![]() 的转化率升高
的转化率升高
【解析】 (1)已知反应①![]() ;②
;②![]() ;③
;③![]() 。反应热等于反应物的键能总和减去生成物的键能总和,所以,
。反应热等于反应物的键能总和减去生成物的键能总和,所以, ![]() (
(![]() )
)![]() .
. ![]() -99
-99 ![]() .
. ![]() ,已知
,已知![]() .
. ![]() ,根据盖斯定律可知,反应③可以由②-①得到,所以,
,根据盖斯定律可知,反应③可以由②-①得到,所以, ![]() .
. ![]() .
. ![]() .
. ![]() 。
。
(2)反应①的化学平衡常数![]() 的表达式为
的表达式为![]() ;图
;图![]() 中能正确反映平衡常数
中能正确反映平衡常数![]() 随温度变化关系的曲线为
随温度变化关系的曲线为![]() ,因为反应①为放热反应,其平衡常数随温度升高而减小.
,因为反应①为放热反应,其平衡常数随温度升高而减小.
(3)由图可知, ![]() 值随温度升高而减小,其原因是:反应①正反应为放热反应,升高温度,平衡向逆反应方向移动,平衡体系中
值随温度升高而减小,其原因是:反应①正反应为放热反应,升高温度,平衡向逆反应方向移动,平衡体系中![]() 的量增大,反应③为吸热反应,升高温度,平衡向正反应方向移动,又使平衡体系中
的量增大,反应③为吸热反应,升高温度,平衡向正反应方向移动,又使平衡体系中![]() 的增大,总结果,随温度升高,
的增大,总结果,随温度升高, ![]() 的转化率减小.图
的转化率减小.图![]() 中的压强由大到小为:
中的压强由大到小为: ![]() ,理由是:相同温度下,反应③前后气体分子数不变,压强改变不影响其平衡移动,反应①正反应为气体分子数减小的反应,增大压强,有利于平衡向正反应方向移动,
,理由是:相同温度下,反应③前后气体分子数不变,压强改变不影响其平衡移动,反应①正反应为气体分子数减小的反应,增大压强,有利于平衡向正反应方向移动, ![]() 的转化率增大,故增大压强有利于
的转化率增大,故增大压强有利于![]() 的转化率升高。
的转化率升高。


科目:高中化学 来源: 题型:
【题目】下列关于生物体化学元素及化合物的叙述,正确的是
A. N是组成细胞内各种有机化合物的必需元素
B. 淀粉、麦芽糖和乳糖的基本单位都是葡萄糖
C. 蛋白质和磷脂是所有细胞中都含有的化合物
D. DNA分子中含核糖
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把质量为mg的铜丝灼烧变成黑色,立即放入下列物质中,使铜丝变成红色,而且质量仍为mg的是 ( )
A. 稀H2SO4 B. C2H5OH C. CH3COOH溶液 D. NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验:
Ⅰ.探究同周期元素性质的递变规律
(1)相同条件下,将钠、镁、铝各1 mol分别投入到足量的同浓度的稀盐酸中,试预测实验结果:_______与稀盐酸反应最剧烈;______与稀盐酸反应产生的气体最多。
(2)向Na2SiO3溶液中加入稀H2SO4出现白色沉淀,可证明S的非金属性比Si强,反应的离子方程式为_____________________________。
Ⅱ.探究同主族元素非金属性的递变规律
某研究性学习小组设计了一组实验来探究ⅦA族元素原子的得电子能力强弱规律。下图中A、B、C是三个可供选择制取氯气的装置,装置D的玻璃管中①、②处依次放置蘸有NaBr溶液、NaOH浓溶液的棉球。

(3)写出装置B中仪器a的名称 ________________。
(4)实验室制取氯气还可采用如下原理:2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O,依据该反应原理选择_____________(填“A”或“B”或“C”)装置制取氯气。
(5)反应装置的导气管连接装置D的X导管,①处发生反应的离子方程式为________________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,物质之间通过一步反应就能实现图示变化的是( )
物质编号 | 物质转化关系 | a | b | c | d |
① |
| NO | NO2 | N2 | HNO3 |
② | Na2O | Na2O2 | Na | NaOH | |
③ | FeCl2 | FeCl3 | Fe | CuCl2 | |
④ | Al2O3 | NaAlO2 | Al | Al(OH)3 |
A.①②③
B.①③④
C.③④
D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种气态烃以任意比例混合,在105℃时1 L该混合烃与9 L氧气混合,充分燃烧后恢复到原状态,所得气体体积仍是10 L。下列各组混合烃中不符合此条件的是 ( )
A. CH4 C3H6 B. CH4 C2H4 C. C2H4 C3H4 D. C2H2 C3H6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)请写出由苯生成硝基苯的化学方程式_________________,反应类型是________。
(2)某烷烃相对分子质量为72,其结构中只有一种氢原子,该烷烃的结构简式为_________,系统名称为__________________。
(3)已知某烃能使溴水和高锰酸钾溶液褪色,将1mol该烃和1mol溴的四氯化碳溶液完全反应,生成1,2—二溴丁烷,则反应的化学方程式为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】数十年来,化学工作者对碳的氧化物和氢化物做了广泛深入的研究并取得了一些重要成果. 已知:C(s)+O2(g)=CO2(g);△H=﹣393kJmol﹣1
2CO (g)+O2(g)=2CO2(g);△H=﹣566kJmol﹣1
2H2(g)+O2(g)=2H2O(g);△H=﹣484kJmol﹣1
(1)工业上常采用将水蒸气喷到灼热的炭层上实现煤的气化(制得CO、H2),该反应的热化学方程式是 .
(2)上述煤气化过程中需向炭层交替喷入空气和水蒸气,喷入空气的目的是;该气化气可在加热和催化剂下合成液体燃料甲醇,该反应方程式为 .
(3)电子工业中使用的一氧化碳常以甲醇为原料通过脱氢、分解两步反应得到. 第一步:2CH3OH(g)═HCOOCH3(g)+2H2(g)△H>0
第二步:HCOOCH3(g)═CH3OH(g)+CO(g)△H>0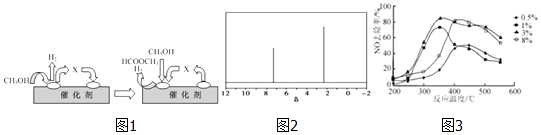
①第一步反应的机理可以用图1表示:图中中间产物X的结构简式为 .
②以甲醇制一氧化碳的反应为反应(填“吸热”、“放热”).
(4)天然气可重整生产化工原料,最近科学家们利用天然气无氧催化重整获得芳香烃X.由质谱分析得X的相对分子质量为106,其核磁共振氢谱如图2,则X的结构简式为 .
(5)C2H4可用于烟气脱硝.为研究温度、催化剂中Cu2+负载量对其NO去除率的影响,控制其他条件一定,实验结果如3图所示.为达到最高的NO去除率,应选择的反应温度和Cu2+负载量分别是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等质量的铜片,在酒精灯上加热后,分别插入下列溶液中,放置一段时间,最终铜片质量不变的是( )
A.硝酸
B.乙醇
C.少量硝酸和硝酸银混合溶液
D.盐酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com