
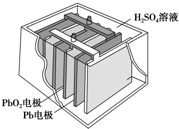
 汽车的启动电源常用铅蓄电池.其结构如图所示,放电时的电池反应如下:PbO2+Pb+2H2SO4═2PbSO4+2H2O根据此反应判断下列叙述中正确的是( )
汽车的启动电源常用铅蓄电池.其结构如图所示,放电时的电池反应如下:PbO2+Pb+2H2SO4═2PbSO4+2H2O根据此反应判断下列叙述中正确的是( )| A. | PbO2是电池的负极 | B. | SO42-向Pb极移动 | ||
| C. | PbO2得电子,被氧化 | D. | 电池放电时,溶液酸性增强 |
分析 根据放电时的电池反应PbO2+Pb+2H2SO4═2PbSO4+2H2O可知,Pb在反应中失去电子,为电池的负极,PbO2在放电过程中得到电子被还原,所以它是原电池的正极;原电池放电的过程中消耗硫酸,所以溶液的酸性减弱,据此进行解答.
解答 解:A.原电池中负极失去电子发生氧化反应,根据电池放电时的反应:PbO2+Pb+2H2SO4═2PbSO4+2H2O可知,负极Pb失去电子,即Pb为负极,PbO2为正极,故A错误;
B.Pb在反应中失去电子生成PbSO4,所以Pb为电池的负极,二氧化铅为正极,硫酸根离子带负电荷,其移动方向与电流方向相反,电解质溶液中电流从负极流向正极,则SO42-向负极(Pb极)移动,故B正确;
C.PbO2在放电过程中化合价降低,得到电子被还原,所以PbO2为原电池的正极、反应中被还原,故C错误;
D.由于原电池放电的过程中消耗硫酸,电解质溶液中氢离子浓度逐渐减小,所以溶液的酸性减弱,故D错误;
故选B.
点评 本题考查了常见的化学电源及工作原理,题目难度中等,注意掌握常见化学电源的类型及工作原理,能够根据原电池总反应判断两极,并能够正确书写电极反应式.


科目:高中化学 来源: 题型:选择题
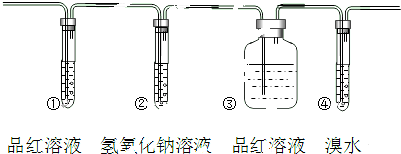
| A. | ①②④ | B. | ①③④ | C. | ①②③④ | D. | ①②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤的干馏,石油分馏 | B. | 石油裂解,煤的气化 | ||
| C. | 金属导电,熔融氯化钠导电 | D. | 金属的焰色反应,浓硫酸吸水 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
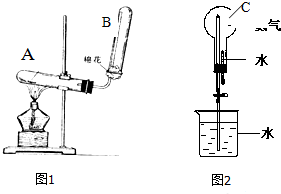 图(1、2)是有关氨的制取和性质的实验装置.
图(1、2)是有关氨的制取和性质的实验装置.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在淀粉与稀硫酸共热后的溶液中,滴加银氨溶液,检验水解产物中的葡萄糖 | |
| B. | 纤维素在人体内可水解生成葡萄糖,进而被氧化为二氧化碳和水,释放能量 | |
| C. | 油脂的水解在碱性条件下可生产肥皂,在酸性条件下生成甘油和高级脂肪酸 | |
| D. | 蛋白质水解的最终产物是氨基酸;遇重金属盐则发生盐析,稀释后仍能溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 核外电子数为奇数的基态原子,其原子轨道中一定含有“未成对电子” | |
| B. | 核外电子数为偶数的基态原子,其原子轨道中一定不含“未成对电子” | |
| C. | 核外电子数为偶数的基态原子,其原子轨道中一定含有“电子对” | |
| D. | 核外电子数为奇数的基态原子,其原子轨道中可能含有“电子对” |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向蛋白质溶液中加饱和硫酸铵溶液,蛋白质析出,如再加水也不溶解 | |
| B. | 蛋白质溶液中蛋白质分子能通过滤纸,但不能通过半透膜 | |
| C. | 浓硝酸溅在皮肤上,能使皮肤呈黄色是由于蛋白质和浓硝酸发生颜色反应 | |
| D. | 重金属盐能使蛋白质变性,吞服钡餐不会引起中毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com