(1)CH
3+、-CH
3(甲基)、CH
3-都是重要的有机反应中间体,有关它们的说法正确的是
A、它们均由甲烷去掉一个氢原子所得
B、它们互为等电子体,碳原子均采取sp
2杂化
C、CH
3-与NH
3、H
2O
+互为等电子体,几何构型均为三角锥形
D、CH
3+中的碳原子采取sp
2杂化,所有原子均共面
E、两个-CH
3(甲基)或一个CH
3+'和一个CH
3-结合均可得到CH
3CH
3(2)锌是一种重要的金属,锌及其化合物有着广泛的应用.
①锌在元素周期表中的位置是:
.
②葡萄糖酸锌〔CH
2OH( CHOH)
4 COO]
2Zn是目前市场上流行的补锌剂.写出Zn
2+基态电子排布式
,葡萄糖分子[CH
2OH(CHOH)
4CHO]中碳原子杂化方式有
③Zn
2+能与NH
3形成配离子[Zn(NH
3)
4]
2+.配位体NH
3分子属于
(填“极性分子”或“非极性分子”);在〔Zn(NH
3)
4]
2+中,Zn
2+位于正四面体中心,N位于正四面体的顶点,试在图1中表示出〔Zn(NH
3)
4]
2+中Zn
2+与N之间的化学键.

④图2示锌与某非金属元素X形成的化合物晶胞,其中Zn和X通过共价键结合,该化合物的Zn与X的原子个数之比为
;
⑤在④的晶胞(图2)中,如果只考查X的排列方式,则X的堆积方式属于金属晶体堆积方式中的_
堆积;设该晶胞中Zn的半径为r
1 cm,其相对原子质量为M
1,X的半径为r
2cm,其相对原子质量为M
2,则该晶体的密度为_
g/cm
3(写出 含有字母的表达式)


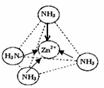 ;
;

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
 某实验小组设计用50mL 1.0mol/L盐酸跟50mL 1.1mol/L氢氧化钠溶液在如图装置中进行中和反应.在大烧杯底部垫泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平.然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过.通过测定反应过程中所放出的热量可计算中和热.试回答下列问题:
某实验小组设计用50mL 1.0mol/L盐酸跟50mL 1.1mol/L氢氧化钠溶液在如图装置中进行中和反应.在大烧杯底部垫泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平.然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过.通过测定反应过程中所放出的热量可计算中和热.试回答下列问题: