
已知:
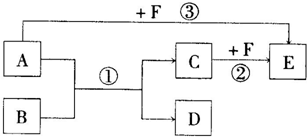
①A、B、C、D四种物质均含元素X,有的还可能含有元素Y、Z.元素Y、X、Z的原子序数依次递增.
②X在A、B、C、D中都不呈现它的最高化合价.
③室温下单质A与某种常见一元强碱溶液反应,可得到B和C.
④化合物D受热催化分解,可制得元素Y的单质.
(1)元素X是________,Z是________.(填写元素符号)
(2)写出③中反应的离子方程式:________.
(3)写出④中反应的化学方程式:________.
 快捷英语周周练系列答案
快捷英语周周练系列答案科目:高中化学 来源: 题型:
| ||
| ||
| 浓硫酸 |
| △ |
| 浓硫酸 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
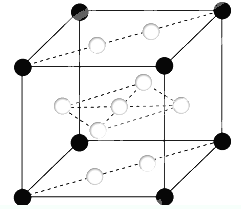 已知:A、B、C、D、E、F、X为周期表中前四周期的七种元素,它们的原子序数依次增大.A是周期表中原子半径最小的元素;B的基态原子有3个不同的能级,各能级中电子数相等;D的基态原子2p能级上的未成对电子数与B原子的相同;D2-离子与E2+离子具有相同的稳定电子层结构;F有“生物金属”之称,F4+离子和氩原子的核外电子排布相同;X的基态原子的价电子排布式为3d84s2.
已知:A、B、C、D、E、F、X为周期表中前四周期的七种元素,它们的原子序数依次增大.A是周期表中原子半径最小的元素;B的基态原子有3个不同的能级,各能级中电子数相等;D的基态原子2p能级上的未成对电子数与B原子的相同;D2-离子与E2+离子具有相同的稳定电子层结构;F有“生物金属”之称,F4+离子和氩原子的核外电子排布相同;X的基态原子的价电子排布式为3d84s2.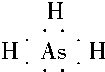
| 3 |
| ||
| 3 |
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
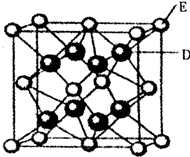 已知:A、B、C、D、E、F是周期表中前36号元素,A是原子半径最小的元素,B元素基态原子的2P轨道上只有两个电子,C元素的基态原子L层只有2对成对电子,D是元素周期表中电负性最大的元素,E2+的核外电子排布和Ar原子相同,F的核电荷数是D和E的核电荷数之和.
已知:A、B、C、D、E、F是周期表中前36号元素,A是原子半径最小的元素,B元素基态原子的2P轨道上只有两个电子,C元素的基态原子L层只有2对成对电子,D是元素周期表中电负性最大的元素,E2+的核外电子排布和Ar原子相同,F的核电荷数是D和E的核电荷数之和.| 5.2×10-22 |
| ρ |
| 5.2×10-22 |
| ρ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
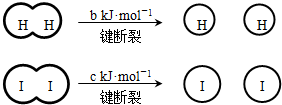 (a、b、c均大于零)
(a、b、c均大于零)| A、反应物的总能量高于生成物的总能量 | B、断开1mol H-H键和1mol I-I键所需能量大于断开2mol H-I键所需能量 | C、断开2mol H-I键所需能量约为(c+b+a)kJ | D、向密闭容器中加入2mol H2和2mol I2,充分反应后放出的热量小于2a kJ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com