
| A. | CuCl2 | B. | SO3 | C. | FeCl3 | D. | NO2 |
科目:高中化学 来源: 题型:推断题
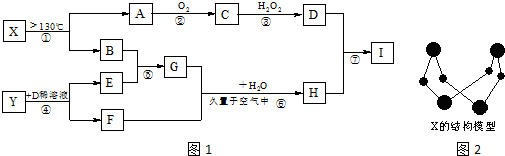
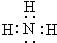 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
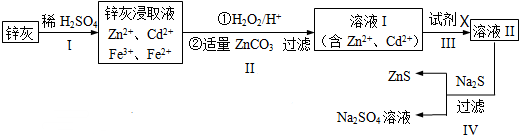
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
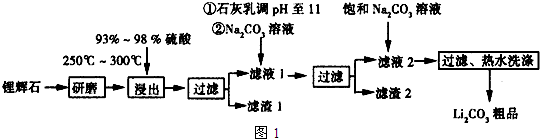
| T/℃ | 20 | 40 | 60 | 80 |
| S(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
| S(Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |
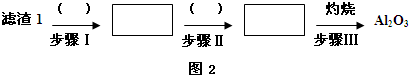
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在离子化合物里,只存在离子键,没有共价键 | |
| B. | 非极性键只存在于双原子的单质分子中 | |
| C. | 任何物质里都含有化学键 | |
| D. | 在共价化合物分子内,一定不存在离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
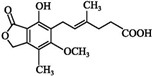
| A. | 分子式为C17H18O6 | B. | 该物质属于脂环化合物 | ||
| C. | 只有两种官能团 | D. | 该物质可发生酯化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有②④⑤ | B. | 只有①②④ | C. | 只有②④ | D. | 只有①②④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com