
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源:2014-2015湖北省襄阳市高二3月月考化学试卷(解析版) 题型:选择题
下列有关化学反应原理的说法不正确的是
A.强酸和强碱的中和反应的活化能接近于零,所以反应速率很高
B.过程的自发性既能用于判断过程的方向,也能用于判断过程发生的速率
C.电解质溶液导电的过程中,一定发生了电解质溶液的电解
D.溶解度较小的BaSO4在一定条件下也可以转化为溶解度略大的BaCO3
查看答案和解析>>
科目:高中化学 来源:2014-2015学年新疆乌鲁木齐地区高三第二次诊断性测试化学试卷(解析版) 题型:选择题
短周期主族元素X、Y、W、Z的原子序数依次增大。其中X、Z同主族,Z的单质是一种良好的半导体材料,W3+与Y2—具有相同的核外电子数。下列叙述正确的是
A.Y2—的离子半径大于W3+的离子半径
B.Y、Z形成的化合物为离子化合物
C.Z的最高价氧化物对应的水化物的酸性比X的强
D.X的气态简单氢化物的稳定性比Y的强
查看答案和解析>>
科目:高中化学 来源:2014-2015学年黑龙江省高三下学期第一次模考化学试卷(解析版) 题型:选择题
下列解释实验事实的化学方程式或离子方程式正确的是
A.用pH试纸检测,氨水溶液呈碱性: NH3·H2O  NH4+ +OH—
NH4+ +OH—
B.100 ℃时,测得纯水中c(H+)·c(OH—) =1×10—12:H2O(l) H+(aq)+OH—(aq)
H+(aq)+OH—(aq) 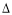 H<0
H<0
C.FeCl3溶液中通入适量SO2,溶液黄色褪去:2Fe3++SO2 +2H2O  2Fe2++SO42—+ 4H+
2Fe2++SO42—+ 4H+
D.向苯酚钠溶液中通入CO2,溶液变浑浊:2C6H5ONa+CO2+H2O → 2C6H5OH+Na2CO3
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省郑州市高三第二次质量预测理综化学试卷(解析版) 题型:填空题
(14分)CO、SO2是主要的大气污染气体,利用化学反应原理是治理污染的重要方法。
I、甲醇可以补充和部分替代石油燃料,缓解能源紧张。利用CO可以合成甲醇。
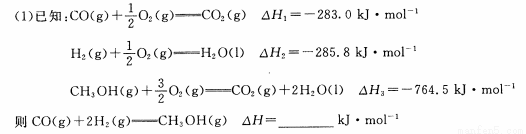
(2)一定条件下,在容积为VL的密闭容器中充入α mol CO与2a mol H2合成甲醇平衡转化率与温度、压强的关系如图所示。
①P1__P2(填“>”、“<”或“=”),理由是
②该甲醇合成反应在A点的平衡常数K= (用a和V表示)
③该反应达到平衡时,反应物转化率的关系是:CO H2(填“>” 、“<” 或“=” )
④下列措施中能够同时满足增大反应速率和提高CO转化率的是 。(填写相应字母)
A、使用高效催化剂
B、降低反应温度
C、增大体系压强
D、不断将CH30H从反应混合物中分离出来
E、增加等物质的量的CO和H2
Ⅱ、某学习小组以SO2为原料,采用电化学方法制取硫酸。
(3)原电池法:该小组设计的原电池原理如图所示。写出该电池负极的电极反应式 。
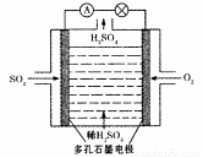
(4)电解法:该小组用Na2SO3溶液充分吸收S02得到NaHSO3溶液,然后电解该溶液制得了硫酸。原理如下图所示。
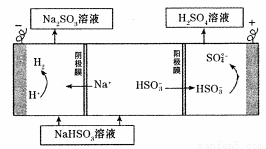
写出开始电解时阳极的电极反应式 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市延庆县高三3月模拟理综化学试卷(解析版) 题型:实验题
(15分)焦亚硫酸钠(Na2S2O5)是一种常用的抗氧化剂。
某研究小组对焦亚硫酸钠进行如下研究:
(1)采用下图装置(实验前已除尽装置内的空气)制取Na2S2O5。
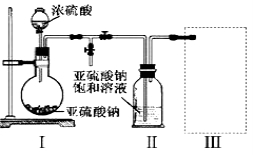
装置Ⅱ中有Na2S2O5析出,发生的化学反应方程式为:Na2SO3 + SO2 = Na2S2O5。
①装置Ⅰ中产生气体的化学方程式为 。
②要从装置Ⅱ中获得已析出的晶体,可采取的分离方法是 。
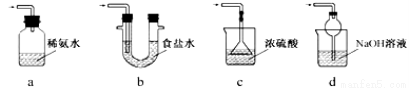
③装置Ⅲ用于处理尾气,可选用的最合理装置(夹持仪器已略去)为 (填序号)。
(2)【查阅资料】Na2S2O5溶于水即生成NaHSO3。
①NaHSO3溶液显酸性。请用化学用语和必要的文字解释原因________________________________;
证明该结论可采用的实验方法是 (填序号)。
a.测定溶液的pH
b.加入Ba(OH)2溶液
c.加入盐酸
d.加入品红溶液
e.用蓝色石蕊试纸检测
②检验Na2S2O5晶体在空气中已被氧化的实验方案是__________________。
(3)焦亚硫酸钠(Na2S2O5)在酸性条件下可将工业废水中的Cr2O72—还原为Cr3+。
①写出该反应的离子方程式_______________________。
②若处理Cr2O72—浓度为1×10-3mol/L的工业废水1L,需用Na2S2O5固体_________mg。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市延庆县高三3月模拟理综化学试卷(解析版) 题型:选择题
下列解释事实的方程式不正确的是
A.测0.01mol/L的醋酸的pH为5:CH3COOH CH3COO- + H+
CH3COO- + H+
B.电解饱和食盐水,产生气体:2Cl- + 2H2O Cl2↑ +2OH- + H2↑
Cl2↑ +2OH- + H2↑
C.铁放在氧气中燃烧,产生黑色固体:4Fe +3O2 2Fe2O3
2Fe2O3
D.硫酸钙与碳酸钠溶液,产生白色沉淀:CaSO4(S)+CO32- CaCO3(S)+SO42-
CaCO3(S)+SO42-
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市房山区高三一模理综化学试卷(解析版) 题型:填空题
(14分)碳和氮的化合物与人类生产、生活密切相关。
(1)C、CO、CO2在实际生产中有如下应用:
a.2C + SiO2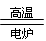 Si + 2CO b.3CO + Fe2O3
Si + 2CO b.3CO + Fe2O3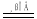 2Fe + 3CO2
2Fe + 3CO2
c.C + H2O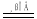 CO + H2 d.CO2 + CH4
CO + H2 d.CO2 + CH4 CH3COOH
CH3COOH
上述反应中,理论原子利用率最高的是 。
(2)有机物加氢反应中镍是常用的催化剂。但H2中一般含有微量CO会使催化剂镍中毒,在反应过程中消除CO的理想做法是投入少量SO2,为搞清该方法对催化剂的影响,查得资料:
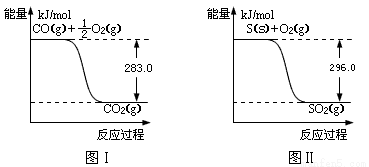
则:① 不用通入O2氧化的方法除去CO的原因是 。
② SO2(g) + 2CO(g) = S(s) + 2CO2(g) △H = 。
(3)汽车尾气中含大量CO和氮氧化物(NO )等有毒气体。
)等有毒气体。
①活性炭处理NO的反应:C(s)+2NO(g) N2(g)+CO2 (g) H=-a kJ·mol-1(a>0)
N2(g)+CO2 (g) H=-a kJ·mol-1(a>0)
若使NO更加有效的转化为无毒尾气排放,以下措施理论上可行的是: 。

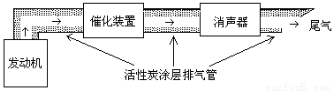
a.增加排气管长度 b.增大尾气排放口
c.添加合适的催化剂 d.升高排气管温度
②在排气管上添加三元催化转化装置,CO能与氮氧化物(NO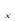 )反应生成无毒尾气,其化学方程式是 。
)反应生成无毒尾气,其化学方程式是 。
(4)利用CO2与H2反应可合成二甲醚(CH3OCH3)。以KOH为电解质溶液,组成二甲醚 空气燃料电池,该电池工作时其负极反应式是 。
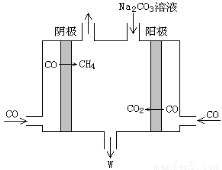
(5)电解CO制备CH4和W,工作原理如图所示,生成物W是 ,其原理用电解总离子方程式解释是 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省韶关市高三调研考试理综化学试卷(解析版) 题型:选择题
下列实验操作、现象与结论对应关系正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 向盛有Fe(NO3)2溶液的试管中加入0.1mol/L H2SO4溶液 | 试管口出现红棕色气体 | 溶液中NO3-被Fe2+还原为NO2 |
B | 向饱和Na2CO3溶液中通入足量CO2 | 溶液变浑浊 | 析出Na2CO3晶体 |
C | 等体积pH=2的HX和HY两种酸分别与足量的铁反应,排水法收集气体 | HX放出的氢气多且反应速率快 | HX酸性比HY弱 |
D | 先向2mL0.1mol/LNa2S溶液中滴几滴0.1mol/LZnSO4溶液,再加入几滴0.1mol/LCuSO4溶液 | 开始有白色沉淀生成;后又有黑色沉淀生成 | Ksp(ZnS)<Ksp(CuS) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com