
【题目】A、B、C、D、E、 F、G是周期表中短周期的七种元素,有关性质或结构信息如下表:
元素 | 有关性质或结构信息 |
A | 地壳中含量最多的元素 |
B | B阳离子与A阴离子电子数相同,且是所在周期中单核离子半径最小的 |
C | C与B同周期,且是所在周期中原子半径最大的(稀有气体除外) |
D | D原子最外层电子数是电子层数的2倍,其氢化物有臭鸡蛋气味 |
E | E与D同周期,且在该周期中原子半径最小 |
F | F的氢化物和最高价氧化物的水化物反应生成一种离子化合物 |
G | G是形成化合物种类最多的元素 |
(1) B元素符号为____,A与C以原子个数比为1:1形成的化合物的电子式为___,用电子式表示C与E形成化合物的过程____, D形成的简单离子的结构示意图为____。
(2) F的氢化物是由____(极性或非极性)键形成的分子,写出实验室制备该氢化物的化学方程式____。
(3) 非金属性D____E(填大于或小于),请从原子结构的角度解释原因:__。
【答案】 Al ![]()
![]()
![]() 极性 2NH4Cl+ Ca(OH)2
极性 2NH4Cl+ Ca(OH)2 ![]() CaCl2+2NH3↑+2H2O 小于 D的原子半径大于E的原子半径,所以得电子的能力比E弱
CaCl2+2NH3↑+2H2O 小于 D的原子半径大于E的原子半径,所以得电子的能力比E弱
【解析】A是地壳中含量最多的元素,则A为O元素;B阳离子与A离子电子数相同,且是所在周期中单核离子半径最小的,则B为Al;C与B同周期,且是所在周期中原子半径最大的(稀有气体除外),则C为Na;D原子最外层电子数是电子层数的2倍,其氢化物有臭鸡蛋气味,则D为S元素;E与D同周期,且在该周期中原子半径最小,则E为Cl;F的氢化物和最高价氧化物的水化物反应生成一种离子化合物,则F为N元素;G是形成化合物种类最多的元素,则G为碳元素;
(1) 由分析可知B元素符号为Al,O与Na以原子个数比为1:1形成的离子化合物Na2O2的电子式为![]() ;离子化合NaCl的电子式形成过程为
;离子化合NaCl的电子式形成过程为![]() , S2-的离子的结构示意图为
, S2-的离子的结构示意图为![]() ;
;
(2) NH3是由极性键形成的极性分子,实验室利用氯化铵和氢氧化钙混合加热制备氨气的化学方程式为2NH4Cl+ Ca(OH)2 ![]() CaCl2+2NH3↑+2H2O;
CaCl2+2NH3↑+2H2O;
(3)S的原子半径大于Cl的原子半径,所以S得电子的能力比Cl弱 ,即S元素的非金属性小于Cl的非金属性。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】【2016上海卷】无水MgBr2可用作催化剂。实验室采用镁屑与液溴为原料制备无水MgBr2,装置如图1,主要步骤如下:
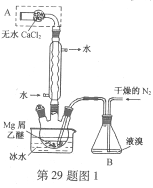
步骤1 三颈瓶中装入10 g镁屑和150 mL无水乙醚;装置B中加入15 mL液溴。
步骤2 缓慢通入干燥的氮气,直至溴完全导入三颈瓶中。
步骤3 反应完毕后恢复至常温,过滤,滤液转移至另一干燥的烧瓶中,冷却至0℃,析出晶体,再过滤得三乙醚合溴化镁粗品。
步骤4 室温下用苯溶解粗品,冷却至0℃,析出晶体,过滤,洗涤得三乙醚合溴化镁,加热至160℃分解得无水MgBr2产品。
已知:①Mg和Br2反应剧烈放热;MgBr2具有强吸水性。
②MgBr2+3C2H5OC2H5![]() MgBr2·3C2H5OC2H5
MgBr2·3C2H5OC2H5
请回答:
(1)仪器A的名称是____________。
实验中不能用干燥空气代替干燥N2,原因是___________。
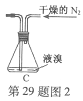
(2)如将装置B改为装置C(图2),可能会导致的后果是___________。
(3)步骤3中,第一次过滤除去的物质是___________。
(4)有关步骤4的说法,正确的是___________。
A.可用95%的乙醇代替苯溶解粗品B.洗涤晶体可选用0℃的苯
C.加热至160℃的主要目的是除去苯D.该步骤的目的是除去乙醚和可能残留的溴
(5)为测定产品的纯度,可用EDTA(简写为Y4-)标准溶液滴定,反应的离子方程式:Mg2++ Y4-====Mg Y2-
①滴定前润洗滴定管的操作方法是__________。
②测定时,先称取0.2500g无水MgBr2产品,溶解后,用0.0500 mol·L-1的EDTA标准溶液滴定至终点,消耗EDTA标准溶液26.50 mL,则测得无水MgBr2产品的纯度是________________________(以质量分数表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应 K2Cr2O7+14HCl(浓)=2CrCl3+2KCl+3Cl2↑+7H2O 中,氧化产物是( )
A. K2Cr2O7B. KClC. CrCl3D. Cl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在常温常压下,将三个分别盛满氨气、氯化氢与空气体积比为3:1的混合气、二氧化氮的等容积烧瓶,再分别倒置于盛水的水槽中,当水进入烧瓶中,并使气体充分溶解后,假定烧瓶中溶液无损失,所得溶液的物质的量浓度之比为
A. 1∶1∶1 B. 5∶5∶4
C. 1∶2∶3 D. 1∶1∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上电解法处理含镍酸性废水并得到单质Ni的原理如图所示。下列说法不正确的
是( )

已知:放电顺序:Ni2+(高浓度)>H+> Ni2+(低浓度)
A. 碳棒上发生的电极反应:4OH--4e-═O2↑+2H2O
B. 为了提高Ni的产率,电解过程中需要控制废水pH
C. 电解过程中,B中NaCl溶液的物质的量浓度将不断增大
D. 若将图中阳离子膜去掉,将A、B两室合并,则电解反应总方程式不会发生改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于下列事实的解释不正确的是
A.在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有脱水性
B.浓硝酸在光照下颜色变黄,说明浓硝酸不稳定
C.常温下,浓硝酸可以用铝罐贮存,说明铝与浓硝酸不反应
D.氨气可以完成喷泉实验,说明氨气极易溶于水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,除标出的元素外,表中的每个编号表示一种元素,请根据要求回答下列问题。
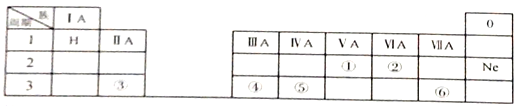
(1)①的原子结构示意图为_________。
(2)③和④两种元素金属性强弱关系是:③______(填“>”或“<”)④
(3)③和⑥两种元素形成的化合物中含有的化学键为_______(填“离子键”或“共价键”) 。
(4)④和⑥组成的化合物的水溶液与AgNO3溶液反应的离子方程式为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com