
【题目】用滴有酚酞和氯化钠溶液的湿润滤纸分别做甲、乙两个实验,下列判断不正确的是( )

A.b极附近有气泡冒出B.d极附近出现红色
C.a、c极上都发生氧化反应D.甲中铁棒比乙中铁棒更易腐蚀
【答案】A
【解析】
甲构成原电池,乙为电解池,甲中铁发生吸氧腐蚀,正极上电极反应式为 2H2O+O2+4e-=4OH-,乙中阴极上电极反应式为:![]() ,水电离出的氢离放电,导致阴极附近有大量
,水电离出的氢离放电,导致阴极附近有大量![]() ,溶液呈碱性,无色酚酞溶液遇碱变红,以此回答。
,溶液呈碱性,无色酚酞溶液遇碱变红,以此回答。
A.b极是正极,发生电极反应式为2H2O+O2+4e-=4OH-,所以无气泡冒出,故A错误;
B.乙中阴极上电极反应式为![]() ,水电离出的氢离子放电导致阴极附近有大量
,水电离出的氢离子放电导致阴极附近有大量![]() ,溶液呈碱性无色酚酞试液遇碱变红色,故B正确;
,溶液呈碱性无色酚酞试液遇碱变红色,故B正确;
C.a是原电池的负极,发生氧化反应;c极是电解池的阳极,发生氧化反应,所以a、c极上都发生氧化反应,故C正确;
D.甲中铁是原电池的负极被腐蚀,而乙中是电解池的阴极被保护,所以甲中铁棒比乙中铁棒更易腐蚀,故D正确;
故选A。


科目:高中化学 来源: 题型:
【题目】测定稀硫酸和稀氢氧化钠中和热的实验装置如下图所示。

(1)理论上强酸强碱的稀溶液反应生成1 mol水时放出57.3 kJ的热量,写出表示稀硫酸和氢氧化钠稀溶液反应的中和热的热化学方程式: ____________________。
(2)仪器A的名称是 _____________;在实验过程中,如果不把温度计上的酸用水冲洗干净就直接测量NaOH溶液的温度,则测得的ΔH_____________ (填“偏大”“偏小”或“无影响”)。
(3)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表。
①请填写下表中的空白: ___________
实验次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 30.1 | |
2 | 27.0 | 27.4 | 27.2 | 33.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
②近似认为0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液的密度都是1 g/cm3中和后生成溶液的比热容c=4.18 J/(g·℃)则中和热ΔH= _____________(取小数点后一位)
③上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是_____________ (填序号)。
a.实验装置保温隔热效果差
b.用量筒量取NaOH溶液的体积时仰视读数
c.分多次把NaO溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,体积和pH都相同的盐酸和醋酸溶液加水稀释时的pH变化曲线如图所示,下列判断正确的是( )
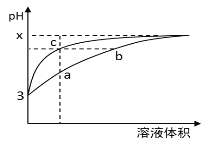
A.c点的溶液导电能力比a点的强
B.水的电离程度a>c = b
C.b、c两点对应的溶液分别与同浓度的氢氧化钠溶液恰好完全反应,消耗氢氧化钠溶液体积c点多
D.b、c两点存在关系:c(Cl-)=c(CH3COO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源是国民经济发展的重要基础,我国目前使用的能源主要是化石燃料。
(1)在25 ℃、101 kPa时,16 g CH4完全燃烧生成液态水时放出的热量是890.31 kJ,则表示CH4燃烧热的热化学方程式是_______________________。
(2)已知:C(s) + O2(g)![]() CO2(g) ΔH1 =-437.3 kJmol-1
CO2(g) ΔH1 =-437.3 kJmol-1
2H2(g) + O2(g) ![]() 2H2O(g) ΔH2 =-571.6 kJmol-1
2H2O(g) ΔH2 =-571.6 kJmol-1
2CO(g) +O2(g)![]() 2CO2(g) ΔH3 =-566.0 kJmol-1
2CO2(g) ΔH3 =-566.0 kJmol-1
则煤气化主要反应的热化学方程式是:C(s)+ H2O(g)![]() CO(g) + H2(g) ΔH =________kJmol-1。如果该反应ΔS =+133.7 J·mol-1·K-1 ,该反应在常温下 _______自发进行(填 “能”或“不能”)。
CO(g) + H2(g) ΔH =________kJmol-1。如果该反应ΔS =+133.7 J·mol-1·K-1 ,该反应在常温下 _______自发进行(填 “能”或“不能”)。
(3) 已知拆开1molH-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则反应N2(g)+3H2(g) ![]() 2NH3 (g) ΔH =_________
2NH3 (g) ΔH =_________
查看答案和解析>>
科目:高中化学 来源: 题型:
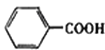
【题目】某芳香烃X是一种重要的有机化工原料,质谱法测定其相对分子质量为92。现以它为初始原料设计出如下转化关系图(部分产物、合成路线、反应条件略去)。其中A是一氯代物,F的分子式为C7H7NO2,Y是一种功能高分子材料。
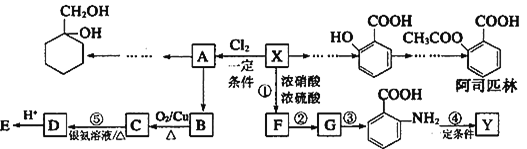
已知:①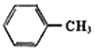
![]()
②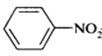
![]()
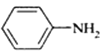 (苯胺,易被氧化)
(苯胺,易被氧化)
请根据所学知识与本题所给信息回答下列问题:
(1)X的名称_____________,其核磁共振氢谱图有____________个吸收峰。
(2)反应⑤的化学方程式是____________。
(3)阿司匹林分子中含有的官能团的名称是_______;1mol阿司匹林与足量NaOH溶液反应最多消耗NaOH的物质的量为_______。
(4)Y的结构简式为_______。
(5)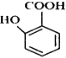 有多种同分异构体,其中含有1个醛基和2个羟基的芳香族化合物共有______种。
有多种同分异构体,其中含有1个醛基和2个羟基的芳香族化合物共有______种。
(6)以下是由A和其它物质合成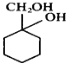 的流程图:A
的流程图:A![]() 甲乙
甲乙![]()
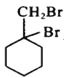
![]()
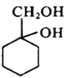 。甲→乙反应的化学方程式为________。
。甲→乙反应的化学方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容条件下发生反应A(g)+3B(g)2 C(g)(△H<0),改变其他反应条件,在Ⅰ、Ⅱ阶段体系中各物质浓度随时间变化的曲线如下图所示,下列说法中正确的是

A.第Ⅰ阶段用C表示的平衡前的反应速率υ (C)=0.1 mol/(L·s)
B.第Ⅱ阶段中B的平衡转化率αⅡ(B)为0.019
C.第Ⅰ阶段的平衡常数KⅠ与第Ⅱ阶段平衡常数KⅡ的大小关系是:KⅠ﹤KⅡ
D.由第一次平衡到第二次平衡,可能采取的措施是从反应体系中移出产物C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积为2 L的密闭容器中,充入2mol CO2 和2mol H2,进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K = _____________;
(2)该反应为____________反应(选填“吸热”或“放热”);
(3)能判断该反应是否达到化学平衡状态的依据是______________;
a.容器中压强不变 b.混合气体中 c(CO)不变
c.υ正(H2)=υ正(H2O) d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为________℃。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏伽德罗常数的值。下列说法正确的是( )
A.将0.2 molFeCl3 水解制成胶体,所得胶体粒子数为0.2 NA
B.25℃时,1LpH=13的Ba(OH)2溶液中含有OH-离子数为0.2 NA
C.0.1mol·L1 NH4Cl溶液中 NH![]() 数小于0.1 NA
数小于0.1 NA
D.1L 2mol·L1K2S溶液中H2S、S2-和HS-的总数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述错误的是
A.12g石墨烯(单层石墨)中含有六元环的个数为0.5NA
B.1mol NaHSO4熔融态时含有2NA个离子
C.含32g硫原子的CS2分子中含有的σ键数目为2NA
D.常温常压下,10 g D2O含有的质子数、电子数、中子数均为5NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com