
①工业上合成氨的生产条件是___________、___________、___________。
②该时间段用N2表示反应速率时v(N2)=___________mol/(L·min)。
③平衡时H2的转化率___________。
(2)等物质的量CaCO3和KHCO3组成的混合物?
①则生成CO2体积(标准状况)___________。
②若该
(1)①
(2)①
解析:(1)依![]() =7.2可算出n(N2)∶n(H2)=1∶4,则混合物中n(N2)=
=7.2可算出n(N2)∶n(H2)=1∶4,则混合物中n(N2)=![]() ×5=1 mol,n(H2)=
×5=1 mol,n(H2)=![]() ×5=4 mol。(2)CaCO3与KHCO3的摩尔质量都为
×5=4 mol。(2)CaCO3与KHCO3的摩尔质量都为![]() =0.16 mol,假设全部为KHCO3,由KHCO3—HCl—CO2知酸过量,产生CO2的物质的量为0.2 mol,则混合物与盐酸反应产生CO2的物质的量范围为0.16 mol<n(CO2)≤0.2 mol。
=0.16 mol,假设全部为KHCO3,由KHCO3—HCl—CO2知酸过量,产生CO2的物质的量为0.2 mol,则混合物与盐酸反应产生CO2的物质的量范围为0.16 mol<n(CO2)≤0.2 mol。
[当n(KHCO3)>0.1 mol且n(CaCO3)<0.1 mol,总耗酸量小于0.32 mol,故n(CO2)可等于0.2 mol。]


科目:高中化学 来源: 题型:
| c3(C) |
| c2(A)c(B) |
| c3(C) |
| c2(A)c(B) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:0119 期中题 题型:填空题
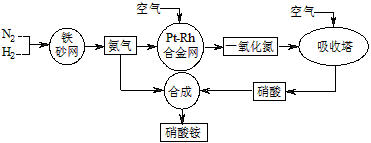
 2NH3(g) ΔH=-92 kJ·mol-1。
2NH3(g) ΔH=-92 kJ·mol-1。 查看答案和解析>>
科目:高中化学 来源: 题型:
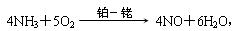
回答下列问题。
(1)合成氨的原料通常各来自何处?_______________________。
(2)已知N2(g)+3H2(g)![]() 2NH3(g),ΔH=-92 kJ。请解释:
2NH3(g),ΔH=-92 kJ。请解释:
为有效提高氨的产率,实际生产中宜采取哪些措施?_______________________。
(3)写出氨催化氧化的化学方程式。铂铑合金网有何作用?为什么铂铑合金网未预热也会发热?
(4)生产硝酸的过程中常会产生一些氮的氧化物,如何消除它们对大气的污染?写出反应的化学方程式。
(5)举出硝酸铵的两种主要用途。请解释为什么该用途对现代社会非常重要。
(6)在一定温度和压强的密闭容器中,将平均相对分子质量为8.5的H2和N2混合,当该反应达到平衡时,测出平衡混合气的平均相对分子质量为10,此时N2的转化率为________,平衡混合气体中NH3的体积分数为________。
(7)请你为硝酸厂的选址提出合理化建议。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com