
【题目】(12分)以硅藻土为载体的五氧化二钒(V2O5)是接触法生成硫酸的催化剂。从废钒催化剂中回收V2O5既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为:
物质 | V2O5 | V2O4 | K2SO4 | SiO2 | Fe2O3 | Al2O3 |
质量分数/% | 2.2-2.9 | 2.8-3.1 | 22-28 | 60-65 | 1-2 | <1 |
以下是一种废钒催化剂回收工艺路线:
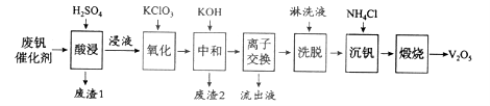
回答下列问题:
(1)“酸浸”时V2O5转化为VO2+,反应的离子方程式为___________,同时V2O4转成VO2+。“废渣1”的主要成分是__________________。
(2)“氧化”中欲使3 mol的VO2+变为VO2+,则需要氧化剂KClO3至少为______mol。
(3)“中和”作用之一是使钒以V4O124形式存在于溶液中。“废渣2”中含有_______。
(4)“离子交换”和“洗脱”可简单表示为:4ROH+ V4O124![]() R4V4O12+4OH(ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈_____性(填“酸”、“碱”或“中”)。
R4V4O12+4OH(ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈_____性(填“酸”、“碱”或“中”)。
(5)“沉钒”得到偏钒酸铵(NH4VO3)沉淀,写出“煅烧”中发生反应的化学方程式____________。
【答案】
(1)V2O5+2H+=2VO2++H2O;SiO2
(2)0.5;
(3)Fe(OH)3、Al(OH)3;
(4)碱;
(5)2NH4VO3![]() V2O5+H2O+2NH3↑
V2O5+H2O+2NH3↑
【解析】
试题分析:从废钒催化剂中回收V2O5,由流程可知,“酸浸”时V2O5转化为VO2+,V2O4转成VO2+.氧化铁、氧化铝均转化为金属阳离子,只有SiO2不溶,则过滤得到的滤渣1为SiO2,然后加氧化剂KClO3,将VO2+变为VO2+,再加KOH时,铁离子、铝离子转化为Fe(OH)3、Al(OH)3沉淀,同时中和硫酸,过滤得到的滤渣2为Fe(OH)3、Al(OH)3,“离子交换”和“洗脱”可简单表示为:4ROH+V4O124-![]() R4V4O12+4OH-,由ROH为强碱性阴离子交换树脂可知,碱性条件下利用反应正向移动,流出液中主要为硫酸钾,“沉钒”得到偏钒酸铵(NH4VO3)沉淀,“煅烧”时分解生成V2O5。
R4V4O12+4OH-,由ROH为强碱性阴离子交换树脂可知,碱性条件下利用反应正向移动,流出液中主要为硫酸钾,“沉钒”得到偏钒酸铵(NH4VO3)沉淀,“煅烧”时分解生成V2O5。
(1)“酸浸”时V2O5转化为VO2+,反应的离子方程式为V2O5+2H+=2VO2++H2O,由上述分析可知滤渣1为SiO2,故答案为:V2O5+2H+=2VO2++H2O;SiO2;
(2)“氧化”中欲使3 mol的VO2+变为VO2+,由电子守恒可知,则需要氧化剂KClO3至少为![]() =0.5mol,故答案为:0.5;
=0.5mol,故答案为:0.5;
(3)由上述流出分析可知滤渣2为Fe(OH)3、Al(OH)3,故答案为:Fe(OH)3、Al(OH)3;
(4)利用强碱性阴离子交换树脂可“离子交换”和“洗脱”,则应选择碱性条件下使用,且OH-浓度大反应逆向移动提高洗脱效率,故答案为:碱;
(5)“煅烧”中发生反应的化学方程式为2NH4VO3![]() V2O5+H2O↑+2NH3↑,故答案为:2NH4VO3
V2O5+H2O↑+2NH3↑,故答案为:2NH4VO3![]() V2O5+H2O↑+2NH3↑。
V2O5+H2O↑+2NH3↑。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】【化学选修2:化学与技术】(15分)
(1)一种从废的镀金黄铜零件中回收金的方法:先将零件磨碎,将粉末加入H2SO4和KNO3的混合溶液中,浸泡数小时后,使其完全溶解,然后将沉淀物滤出。上述方法中,将废料磨碎的目的是_________,溶出铜的离子方程式为____________________。
(2)工业上采用电解法处理NO制备NH4NO3。工作原理如图所示,则阳极的电极反应式为________,通入的物质X的化学式为____________,若电路中通过15mol电子,则理论上最多可制备NH4NO3的物质的量为_________。
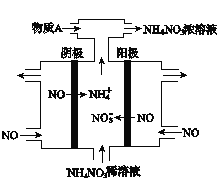
(3)如图是从含有CuCl2的酸性蚀刻液中制取无机催化剂CuCl的流程:

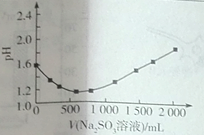
①反应I进行时,反应体系的pH与Na2SO3溶液的添加量的关系如图所示,则反应I的离子方程式为________。
②过滤后的物质用含乙醇的洗涤液洗涤,原因是_________________。
③准确称取0.25gCuCl样品置于一定量的FeCl3溶液中,待样品完全溶解后,加水至20mL,用0.050mol/L的K2Cr2O7标准溶液滴定至终点,消耗8.12mLK2Cr2O7溶液,则该样品中CuCl的质量分数为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年8月17日,广东警方查获黑窝点非法使用Na2S2O4等浸泡食物来达到保鲜作用,Na2S2O4俗称保险粉,大量用于漂白纸张和印染工业。某学习小组用下列方法制备该物质。
①把甲酸(HCOOH)溶于甲醇溶液,再和足量的NaOH溶液混合配成溶液;
②制取SO2并通入上述溶液中,一段时间后可获得保险粉。
(已知:Na2S2O4在水中溶解度较大,在甲醇中溶解度较小)
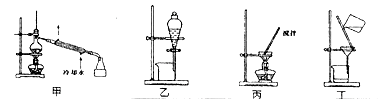
装置如图所示:

(1)A装置中的分液漏斗改为 (仪器名称)更合适,D中盛放的试剂为 。
(2)B装置的作用为 ;
(3)C装置内发生的化学反应方程式为 。
(4)分离C装置中产品时就选用下列装置 (填甲、乙、丙、丁,下同),回收乙醇的装置为 。
(5)Na2S2O4在碱性环境中除去废水中的CrO42-及+4价S的化合物,反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学-选修2:化学与技术】(15分)
实验室用MnO2、KOH及KClO3原料制取高锰酸钾的实验流程如下:
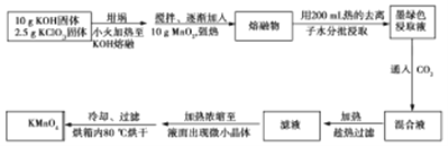
回答下列问题:
(1)实验中采用_______(填“铁坩埚”或“瓷坩埚”)加热KOH和KClO3固体混合物。
(2)熔融时,MnO2转化为K2MnO4,KClO3转化为KCl,该反应的化学方程式为__________。
(3)几种物质的溶解度曲线如图所示。
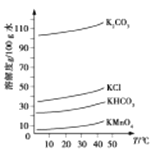
①通入CO2至pH为10~11, K2MnO4转化为KMnO4和MnO2,该反应的离子方程式为_________。
②不能通入过量CO2的原因是_____________。
(4)趁热过滤的目的是_________;用冷水洗涤KMnO4晶体较好的原因是_____________。
(5)计算经过上述转化,最多可制得KMnO4质量为________(结果保留2位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学实验有助于理解化学知识,形成化学观念,提高探究与创新能力,提升科学素养。I.在具支试管中加入碎瓷片和无水硫酸铝,用注射器吸取一定量石蜡油,重新连接好装置;点燃酒精灯,加热具支试管中的碎瓷片和无水硫酸铝的混合物约两分钟;将注射器中的石蜡油缓慢、逐次推入具支试管中,石蜡油与灼热的碎瓷片和无水硫酸铝接触,将所得气体依次通入酸性高锰酸钾溶液和溴水中,发现酸性高锰酸钾溶液和溴水均褪色.,将导气管迅速替换成燃烧尖嘴,点燃气体,火焰明亮,有黑烟。

(1)碎瓷片和无水硫酸铝的作用是___________。
(2)通过本实验说明____________________。
II.实验室可用氯气与金属铁反应制备无水三氯化铁,三氯化铁呈棕红色、易潮解,100![]() 左右时升华。某化学兴趣小组利用下列实验装置制备并收集无水三氯化铁。
左右时升华。某化学兴趣小组利用下列实验装置制备并收集无水三氯化铁。
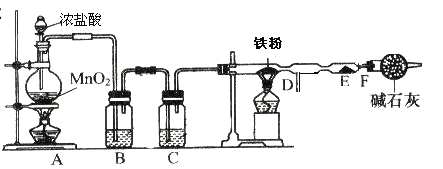
(3)A装置中发生反应的离子方程式为 ;
(4)实验时,先点燃A处的酒精灯,当D管处颜色变黄绿色时,再点燃D处的酒精灯,这样操作是为了 。
(5)B装置中应盛放的试剂名称为 ;
(6)F装置所起的作用是阻止空气中的水进入反应器,防止无水三氯化铁潮解和
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题:
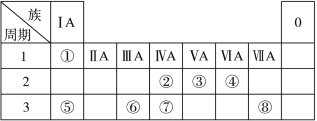
(1)地壳中含量最高的金属元素在周期表中的位置是 。
(2)⑧形成的单质与水反应的离子方程式为 。
(3)②⑦的非金属性强弱可通过比较这两种元素 (填编号)
a.原子的得电子的能力
b.含氧酸的酸性
c.气态氢化物的稳定性
d.单质的熔沸点
(4)写出一种由④⑤⑧元素形成的既含有离子键又含有共价键的物质的电子式 。
(5)化工行业最近合成了由元素②和③形成的化合物,其硬度比金刚石还大。该物质所形成的晶体还可能具有的性质或特点有 (填编号)
①熔点很高
②可以导电
③不存在单个分子
④具有空间网状结构
(6)①和③形成的某液态化合物摩尔质量与氧气相同。在常温常压下0.25 mol该液态物质在足量的氧气中完全燃烧生成③的气态单质和液态水,同时放出QkJ的热量。写出该反应的热化学方程式____________________________ ______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纯碱(Na2CO3)在生产生活中具有广泛的用途。以下是实验室模拟制碱原理制取Na2CO3的流程图
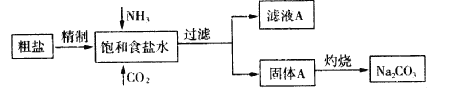
请回答以下问题:
(1)粗盐中含有的杂质离子有Ca2+,Mg2+,SO42-等。粗盐溶解之后,依次加入下列药品:
足量NaOH溶液、 、 除杂,然后过滤,向滤液中加入适量盐酸得到精制食盐水。
(2)向饱和食盐水中通氨气和二氧化碳反应的方程式为: 。
(3)可以区别A固体和Na2CO3固体的方法有 。
A.利用热稳定性不同,加热固体并将生成的气体通入澄清石灰水中,观察是否有浑浊
B.将相同浓度的盐酸逐滴滴入相同浓度的上述固体的溶液中,观察气体产生的速率
C.向相同浓度的两种固体的溶液中滴入酚酞试液,观察溶液颜色的深浅
D.取两种固体配成的溶液,分别加入BaCl2溶液,观察是否有固体生成
E.取两种固体配成的溶液,分别加入Ba(OH)2溶液,观察是否有固体生成
F.取两种固体配成的溶液,分别测量溶液的pH值并比较大小
(4)检验滤液A中含有的阳离子的方法为______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com