
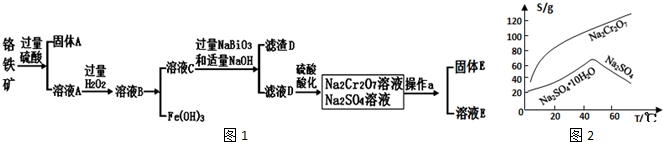
分析 铬铁矿(主要成分为FeO和Cr2O3,含有Al2O3、SiO2等杂质),加入过量稀硫酸,固体A为SiO2,溶液A中含有Cr3+、Al3+、Fe2+,在A中加入过氧化氢,可生成Fe3+,调节溶液pH可除去Fe3+、Al3+,生成氢氧化铁、氢氧化铝沉淀,即固体D,溶液C含有Cr3+,在溶液C中加入NaBiO3和NaOH,发生氧化还原反应,固体D为Bi(OH)3,溶液D含有Na2CrO4,酸化可得Na2Cr2O7,溶液经蒸发浓缩、冷却结晶可得Na2Cr2O7•2H2O,
(1)三氧化二铬与铝在高温条件下发生置换反应生成铬与三氧化二铝;
(2)盐酸中的氯是-1价具有还原性,会CrO42-被氧化成氯气;
(3)由图2可知Na2Cr2O7的溶解度随温度的升高而增大,而硫酸钠的温度随温度的升高而降低,所以采用蒸发结晶、趁热过滤的方法分离硫酸钠;
(4)①Cr(OH)3的化学性质与Al(OH)3相似,如果氢氧化钠过量Cr(OH)3会溶解;
②可以代替上述流程中Na2S2O3溶液,需要具有还原性,能还原重铬酸根离子;
③根据Ksp[Cr(OH)3]=c(Cr3+)•(OH-)3,来计算铬离子的浓度是否小于10-5mol/L;
④每消耗0.1mol Na2S2O3转移0.8mol e-,Na2S2O3 ~2SO42-~8e-,Cr2O72-~2Cr3+~6e-,依据氧化还原反应电子守恒分析配平书写氧化还原反应的离子方程式.
解答 解:(1)三氧化二铬与铝发生铝热反应的方程式为:Cr2O3+2Al$\frac{\underline{\;高温\;}}{\;}$2Cr+Al2O3;
故答案为:Cr2O3+2Al$\frac{\underline{\;高温\;}}{\;}$2Cr+Al2O3 ;
(2)盐酸中的氯是-1价具有还原性,会CrO42-被氧化成氯气,
故答案为:盐酸中的Cl-会被氧化,产生Cl2;
(3)由图2可知Na2Cr2O7的溶解度随温度的升高而增大,而硫酸钠的温度随温度的升高而降低,所以采用蒸发结晶、趁热过滤的方法分离硫酸钠,
故答案为:蒸发结晶、趁热过滤;
(4)①Cr(OH)3的化学性质与Al(OH)3相似,如果氢氧化钠过量Cr(OH)3会溶解,发生离子方程式为Cr(OH)3+OH-=CrO2-+2H2O,
故答案为:Cr(OH)3+OH-=CrO2-+2H2O;
②可以代替上述流程中Na2S2O3溶液,需要具有还原性,能还原重铬酸根离子;
A.FeSO4溶液中亚铁离子具有还原性,可以还原Cr2O72-离子,但又引入新的杂质离子铁离子,故A不符合;
B.浓H2SO4 具有强氧化性,不能表现还原性,不能还原Cr2O72-,故B不符合;
C.酸性KMnO4 是强氧化剂不能还原Cr2O72-,故C不符合;
D.Na2SO3溶液中亚硫酸根离子具有还原性,可以还原Cr2O72-,故D符合;
故答案为:D;
③pH=5时,(OH-)=10-9mol/L,所以c(Cr3+)•(10-9)3=6.3×10-31,解之得c(Cr3+)=6.3×10-4>10-5,所以没有沉淀完全,
故答案为:c(Cr3+)•(10-9)3=6.3×10-31,解之得c(Cr3+)=6.3×10-4>10-5,所以没有沉淀完全;
④每消耗0.1mol Na2S2O3转移0.8mol e-,Na2S2O3 ~2SO42-~8e-,Cr2O72-~2Cr3+~6e-,依据氧化还原反应电子守恒配平书写,3Na2S2O3 ~6SO42-~24e-,4Cr2O72-~8Cr3+~24e-,得到的氧化还原反应的离子方程式为3S2O32-+4Cr2O72-+26H+═6SO42-+8Cr3++13H2O;
故答案为:3S2O32-+4Cr2O72-+26H+═6SO42-+8Cr3++13H2O.
点评 本题考查了物质分离提纯的方法和过程分析,离子方程式书写,溶度积常数的计算应用,主要是氧化还原反应的理解应用,掌握基础是关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 热稳定性:HBr>HCl | B. | 碱性:Al(OH)3<Mg(OH)2 | ||
| C. | 氧化性:O<F | D. | 还原性:S2->O2- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2NA个H2与O2恰好反应,消耗氧气的体积约是22.4L | |
| B. | 1molC12与足量Fe反应,转移的电子数为3NA | |
| C. | 0.1molNaHSO4固体中,共含有0.2 NA个离子 | |
| D. | 在标准状况下,lLpH=13的NaOH溶液中,含有0.1NA个OH-(不考虑水的电离) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 0.20 | 20.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
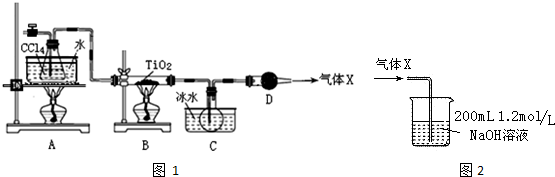
| 物质 | 熔点/℃ | 沸点/℃ | 其他 |
| CCl4 | -23 | 76.8 | 与TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮湿空气产生白雾 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 温度 | 25℃ | 50℃ | 95℃ |
| 溶解度 | 0.17g | 0.95g | 6.8g |
| 物质 | 甲醇 | 苯甲酸 | 苯甲酸甲酯 |
| 相对分子质量 | 34 | 122 | 136 |
| 沸点/℃ | 64.7 | 249 | 199.6 |
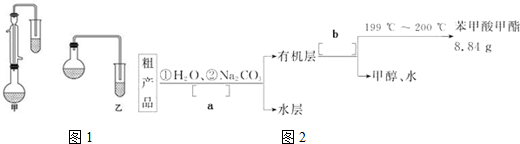
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
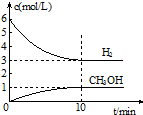 T℃时,在1L的密闭容器中充入2mol CO2和6mol H2,发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1.测得H2和CH3OH(g)的浓度随时间变化情况如图所示:下列说法不正确的是( )
T℃时,在1L的密闭容器中充入2mol CO2和6mol H2,发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1.测得H2和CH3OH(g)的浓度随时间变化情况如图所示:下列说法不正确的是( )| A. | 0~10min内v(H2)=0.3 mol•L-1•min-1 | |
| B. | T℃时,平衡常数K=$\frac{1}{27}$,CO2与H2的转化率相等 | |
| C. | T℃时,当有32 g CH3OH生成时,放出49.0 kJ的热量 | |
| D. | 达到平衡后,升高温度或再充入CO2气体,都可以提高H2的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若a+b<c+d,增大压强,则平衡向左移动 | |
| B. | 若从正反应开始,起始时A、B的物质的量之比为a:b,则平衡时A、B的转化率之比为a:b | |
| C. | 若a+b=c+d,在平衡体系中共有气体m mol,再向其中充入n mol B,则达到平衡时气体总物质的量小于(m+n)mol | |
| D. | 若a+b=c+d,则对于体积不变的容器,升高温度,平衡向左移动,容器中气体压强不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com