
| A. | ①③ | B. | ①④ | C. | ①② | D. | ③④ |
分析 若经3s(秒)后测得C的浓度为0.6mol•L-1,生成C为0.6mol/L×2L=1.2mol,则
2A(g)+B(g)?2C(g)
开始 6 3 0
转化 1.2 0.6 1.2
3s 4.8 2.4 1.2
结合v=$\frac{△c}{△t}$、c=$\frac{n}{V}$计算.
解答 解:若经3s(秒)后测得C的浓度为0.6mol•L-1,生成C为0.6mol/L×2L=1.2mol,则
2A(g)+B(g)?2C(g)
开始 6 3 0
转化 1.2 0.6 1.2
3s 4.8 2.4 1.2
①用物质A表示的反应的平均速率为$\frac{\frac{1.2mol}{2L}}{3s}$=0.2mol•(L•s)-1,故正确;
②用物质B表示的反应的平均速率为$\frac{\frac{0.6mol}{2L}}{3s}$=0.1mol•(L•s)-1,故错误;
③3s时物质B的转化率为$\frac{0.6mol}{3mol}$×100%=20%,故错误;
④3s时物质B的浓度为$\frac{2.4mol}{2L}$=1.2mol•L-1,故正确;
故选B.
点评 本题考查化学平衡的计算,为高频考点,把握化学平衡三段法、速率及转化率的计算为解答的关键,侧重分析与计算能力的综合考查,注意转化的物质的量关系,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:实验题
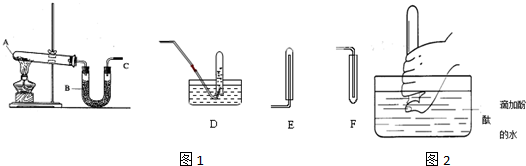
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
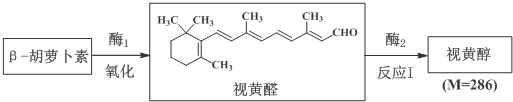
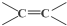 $\stackrel{氧化}{→}$
$\stackrel{氧化}{→}$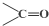 +
+
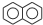 ,C10H8)的衍生物,其可能具有的化学性质有bd(选填编号).
,C10H8)的衍生物,其可能具有的化学性质有bd(选填编号).
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇的官能团是:-OH | B. | 乙醇的分子式是:CH3CH2OH | ||
| C. | 乙烯的结构简式是:CH2CH2 | D. | 乙烯无官能团 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 臭氧层破坏 | B. | 温室效应 | C. | 酸雨 | D. | 光化学烟雾 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 提高硫酸厂尾气的回收效率 | |
| B. | 强制燃煤企业完善脱硫设备 | |
| C. | 用天然气代替含硫的煤作民用燃料 | |
| D. | 减少全球工业化生产过程的CO2气体年排放总量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | T | X | Y | Z |
| 性质 结构 信息 | 人体内含量最多的元素,且其单质是常见的助燃剂. | 单质为双原子分子,分子中含有3对共用电子对,常温下单质气体性质稳定,但其原子较活泼. | 单质质软、银白色固体、导电性强. 单质在空气中燃烧发出黄色的火焰. | 第三周期元素的简单离子中半径最小 |
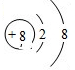 ;写出元素X的气态氢化物的电子式
;写出元素X的气态氢化物的电子式 ;离子半径比较:Y离子>Z离子(填“>”或“<”).
;离子半径比较:Y离子>Z离子(填“>”或“<”).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有机物X的键线式为:
有机物X的键线式为: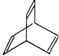
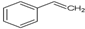
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com