
| A. | n(SO3)>n(SO2) | B. | n(SO3)=1mol | C. | 1mol<n(SO3)<2mol | D. | n(SO2)+n(SO3)=2mol |
分析 将2molSO2和0.5molO2通入密闭容器中,反应是可逆的,反应物不能完全转化为产物,根据反应的可逆性来回答.
解答 解:A、将2molSO2和0.5molO2通入密闭容器中,假设氧气完全转化,则还剩余二氧化硫1mol,生成三氧化硫1mol,所以消耗的二氧化硫和生成的三氧化硫相等,但是氧气消耗量小于0.5mol,所以生成的三氧化硫小于1mol,剩余的二氧化硫大于1mol,即n(SO3)<n(SO2),故A错误;
B、将2molSO2和0.5molO2通入密闭容器中,假设氧气完全转化,则还剩余二氧化硫1mol,生成三氧化硫1mol,所以消耗的二氧化硫和生成的三氧化硫相等,但是氧气消耗量小于0.5mol,所以生成的三氧化硫小于1mol,故B错误;
C、将2molSO2和0.5molO2通入密闭容器中,假设氧气完全转化,则还剩余二氧化硫1mol,生成三氧化硫1mol,所以消耗的二氧化硫和生成的三氧化硫相等,但是氧气消耗量小于0.5mol,所以生成的三氧化硫小于1mol,故C错误;
D、将2molSO2和0.5molO2通入密闭容器中,假设氧气完全转化,则还剩余二氧化硫1mol,生成三氧化硫1mol,所以消耗的二氧化硫和生成的三氧化硫相等,n(SO2)+n(SO3)=2mol,故D正确.
故选D.
点评 本题考查了化学平衡的计算,题目难度中等,注意明确可逆反应特点为解答关键.


科目:高中化学 来源: 题型:多选题
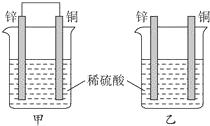
| A. | 两烧杯中溶液的pH值均增大 | B. | 产生气泡的速率甲比乙快 | ||
| C. | 两烧杯中铜片表面均无气泡产生 | D. | 甲中铜片是正极,乙中锌片是负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 H2、CH3OH是优质的清洁燃料,可制作燃料电池.
H2、CH3OH是优质的清洁燃料,可制作燃料电池.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有4种不同的伸展方向 | B. | 有14种不同运动状态的电子 | ||
| C. | 有5种不同能量的电子 | D. | 有5种不同的运动范围 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H(${\;}_{1}^{1}$H),D(${\;}_{1}^{2}$H),T(${\;}_{1}^{3}$H)表示三种氢原子 | |
| B. | 原子最外层少于4个电子的元素均是金属元素 | |
| C. | 稀有气体元素最外层电子数均为8个 | |
| D. | 目前人们已发现了5000多种核素,说明发现了5000多种元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子化合物中只含离子键 | B. | 共价化合物中不含离子键 | ||
| C. | 离子化合物中不可能含共价键 | D. | 共价化合物中可能含离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属铝在空气中不易被腐蚀 | |
| B. | 铁制器件在潮湿空气中生锈 | |
| C. | 镀锌铁片比镀锡铁片更耐腐蚀 | |
| D. | 远洋海轮的外壳连接锌块可保护轮船不受腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com