
【题目】图中A~K分别代表一种物质.已知A易溶于水,分解得到B、C、D的物质的量比为1:1:2,B气体能使品红溶液褪色,C为常见的液体,D气体能使湿润的紫色石蕊试纸变蓝,F为淡黄色固体单质,K为常见的二元强酸,图中有部分生成物未标出.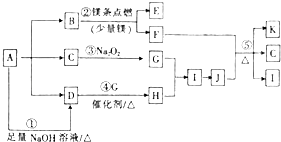
(1)A的化学式为 .
(2)写出反应①的离子方程式: .
(3)写出反应②、④、⑤的化学方程式:②;
④;
⑤ .
(4)在反应③中,每生成标准状况下2.24L G时,转移电子的物质的量为mol.
【答案】
(1)(NH4)2SO3
(2)NH ![]() +OH﹣
+OH﹣ ![]() NH3↑+H2O
NH3↑+H2O
(3)2Mg+SO2 ![]() 2MgO+S;4NH3+5O2
2MgO+S;4NH3+5O2 ![]() 4NO+6H2O;S+6HNO3(浓)
4NO+6H2O;S+6HNO3(浓) ![]() 6NO2↑+H2SO4+2H2O
6NO2↑+H2SO4+2H2O
(4)0.2
【解析】解:已知A易溶于水,分解得到B、C、D的物质的量比为1:1:2,D气体能使湿润的紫色石蕊试纸变蓝,A能与氢氧化钠反应达到D,则D为NH3 , A为铵盐,而B气体能使品红溶液褪色,C为常见的液体,则B为SO2 , C为H2O,可知A为(NH4)2SO3 . 过氧化钠与水反应生成G,G能与氨气反应生成H,H与G进一步反应生成I,则G为O2 , H为NO,I为NO2 , B与Mg反应生成淡黄色固体单质F,则F为S、E为MgO,硫与J反应生成K、水、NO2 , 且K为常见的二元强酸,则H为HNO3 , K为H2SO4 . (1)A的化学式为:(NH4)2SO3 , 所以答案是:(NH4)2SO3;(2)反应①的离子方程式:NH4++OH﹣ ![]() NH3↑+H2O,所以答案是:NH
NH3↑+H2O,所以答案是:NH ![]() +OH﹣
+OH﹣ ![]() NH3↑+H2O;(3)反应②的方程式为:2Mg+SO2
NH3↑+H2O;(3)反应②的方程式为:2Mg+SO2 ![]() 2MgO+S,反应④的方程式为:4NH3+5O2
2MgO+S,反应④的方程式为:4NH3+5O2 ![]() 4NO+6H2O,反应⑤的方程式为:S+6HNO3(浓)
4NO+6H2O,反应⑤的方程式为:S+6HNO3(浓) ![]() 6NO2↑+H2SO4+2H2O,所以答案是:2Mg+SO2
6NO2↑+H2SO4+2H2O,所以答案是:2Mg+SO2 ![]() 2MgO+S;4NH3+5O2
2MgO+S;4NH3+5O2 ![]() 4NO+6H2O;S+6HNO3(浓)
4NO+6H2O;S+6HNO3(浓) ![]() 6NO2↑+H2SO4+2H2O;(4)在反应③为2Na2O2+2H2O=4NaOH+O2↑,反应中过氧化钠起氧化剂、还原剂作用,每生成标准状况下2.24L O2时,转移电子的物质的量为
6NO2↑+H2SO4+2H2O;(4)在反应③为2Na2O2+2H2O=4NaOH+O2↑,反应中过氧化钠起氧化剂、还原剂作用,每生成标准状况下2.24L O2时,转移电子的物质的量为 ![]() ×2=0.2 mol,所以答案是:0.2.
×2=0.2 mol,所以答案是:0.2.


科目:高中化学 来源: 题型:
【题目】运用盖斯定律可计算一些不易测定的反应的反应热.
(1)已知在298K时下述反应的有关数据:C(s)+ ![]() O2(g)=CO(g)△H1=﹣110.5kJmol﹣1 , C(s)+O2(g)=CO2(g)△H2=﹣393.5kJmol﹣1 . 则C(s)+CO2(g)=2CO(g) 的△H为 .
O2(g)=CO(g)△H1=﹣110.5kJmol﹣1 , C(s)+O2(g)=CO2(g)△H2=﹣393.5kJmol﹣1 . 则C(s)+CO2(g)=2CO(g) 的△H为 .
(2)火箭发射时可用肼(N2H4)为燃料,以二氧化氮作氧化剂,它们相互反应生成氮气和水蒸气.已知:N2(g)+2O2(g)=2NO2(g)△H=+67.7kJmol﹣l;N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=﹣534kJmol﹣l . 则N2H4和NO2反应生成氮气和水蒸气的热化学方程式为
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,在1L的密闭容器中充入NO2发生如下反应:2NO2(g)N2O4(g);△H=﹣57kJmol﹣1
(1)该反应的△S0(填“>”、“<”或“=”).
(2)当开始充入0.03mol的NO2时,25℃时,实验测得NO2的平衡浓度为0.01molL﹣1 , 则NO2的平衡转化率(α)是 . 25℃时上述反应的平衡常数K= .
(3)25℃时,实验测得该反应的活化能Ea=92.4kJmol﹣1 . 下列能量关系图合理的是 . 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是处理蚀刻电路板废液(含有FeCl2、FeCl3、CuCl2)回收FeCl3溶液的方案,下列有关说法正确的是( ) 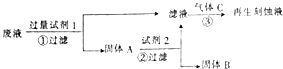
A.试剂1可以是铁也可以是铜
B.试剂2可以是盐酸也可以是硫酸
C.气体C为Cl2 , 不能用H2O2替换
D.步骤①②③中发生的反应均为氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E五种常见化合物,都是由下表中的离子形成的:
阳离子 | K+、Na+ 、Cu2+、 Al3+ |
阴离子 | SO |
为了鉴别上述化合物,分别完成以下实验,其结果是:
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀溶解;
③进行焰色反应,仅有B为紫色(透过蓝色钴玻璃);
④在各溶液中加入硝酸酸化的硝酸钡溶液,只有A中放出无色气体,只有D中产生白色沉淀;
⑤将B、C两溶液混合,未见沉淀或气体生成.根据上述实验填空:
(1)写出B、D的化学式:B , D .
(2)C可用作净水剂,用离子方程式表示其净水原理 .
(3)将含0.01mol A的溶液与含0.02mol E的溶液反应后,向溶液中滴加0.1molL﹣1稀盐酸.下列图象能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是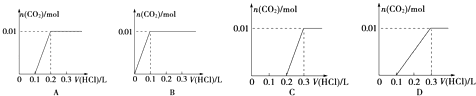
(4)在mmL b molL﹣1 C溶液中,加入等体积a molL﹣1 的E溶液.当a≤3b时,生成沉淀的物质的量是 mol;当3b<a<4b件时,生成沉淀的物质的量是 mol.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g),下列叙述正确的是
4NO(g)+6H2O(g),下列叙述正确的是
A. 达到化学平衡时4v正(O2)=5v逆(NO)
B. 若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
C. 达到化学平衡时,若增大容器容积,则正反应速率减小,逆反应速率增大
D. 化学反应速率关系:2v正(NH3)=3v正(H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液,一定呈中性的是
A. 由等体积、等物质的量浓度的硫酸跟NaOH溶液混合后所形成的溶液
B. c(H+)=1.0×10-7mol·L-1的溶液
C. pH=7的溶液
D. c(H+)=![]() 的溶液(Kw为该温度下水的离子积常数)
的溶液(Kw为该温度下水的离子积常数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.所有卤代烃都难溶于水,且都是密度比水大的液体
B.卤代烃不属于烃类
C.所有卤代烃都是通过取代反应制得
D.卤代烃都是良好的有机溶剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组请你参与“研究铁与水反应所得固体物质的成分、性质及再利用”实验探究,并共同解答下列问题: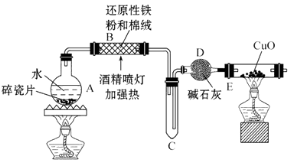

图1 图2
(1)探究一:设计如图1所示装置进行“铁与水反应”的实验.
a.硬质玻璃管B中发生反应的化学方程式为 .
b.反应前A中投放碎瓷片的目的是 .
c.装置E中的现象是 .
(2)探究二:设计如下实验方案确定反应后硬质玻璃管B中黑色固体的成分.
a.待硬质玻璃管B冷却后,取少许其中的固体物质溶于后,将所得溶液分成两份.
b.一份滴加几滴KSCN溶液.若溶液变血红色,推断硬质玻璃管B中固体物质的成分为(选填序号,下同);若溶液未变血红色,推断硬质玻璃管B中固体物质的成分为 .
①一定有Fe3O4 ②一定有Fe ③只有Fe3O4 ④只有Fe
c.另一份用(填仪器名称)加入 , 可以证明溶液中存在Fe2+ .
(3)探究三:设计如下流程(如图2)测定反应后硬质玻璃管B中固体含铁元素的质量分数.
a.试剂b的化学式是 .
b.计算反应后B装置中铁元素的质量分数为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com