
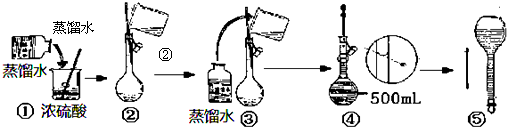
分析 Ⅰ.(1)根据浓硫酸在稀释前后,溶质的物质的量保持不变进行计算;
(2)容量瓶是配制一定体积准确浓度的标准溶液的定容仪器;
(3)稀释浓硫酸时是将浓硫酸倒入水中,并用玻璃棒不断搅拌,使产生的热量迅速扩散;读数时应平视;
(4)根据公式c=$\frac{n}{V}$,可以根据影响n和V的因素来分析回答;
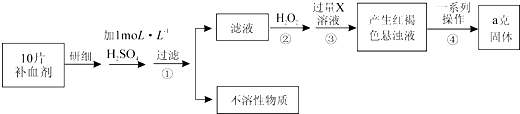
Ⅱ.由流程图可知,该实验原理为:将药品中的Fe2+形成溶液,将Fe2+氧化为Fe3+,使Fe3+转化为氢氧化铁沉淀,再转化为氧化铁,通过测定氧化铁的质量,计算补血剂中铁元素的含量,
(1)步骤②加入过量H2O2将Fe2+氧化为Fe3+;
(2)由氢氧化铁悬浊液最终转化为氧化铁,需要过滤、洗涤的氢氧化铁,然后灼烧生成氧化铁,冷却后称量氧化铁的质量;
(3)根据铁元素守恒可知ag氧化铁中铁元素的质量即为10片补血剂中铁的质量,据此计算.
解答 解:Ⅰ.(1)浓硫酸在稀释前后,溶质的物质的量保持不变,设所需浓硫酸最小体积为V,则100mL×10-3×1mol/L=10mol/L×V,解得V=10.0mL,
故答案为:10.0;
(2)容量瓶作为精密仪器不可用于储存和溶解,也不能测量除其规格以外容积的液体体积,
故答案为:A;
(3)稀释浓硫酸时是将浓硫酸沿器壁倒入水中,并用玻璃棒不断搅拌,使产生的热量迅速扩散;读数时应平视,不能仰视和俯视,
故答案为:①④;
(4)A.洗涤烧杯2~3次,并将洗涤液移入容量瓶,否则浓度偏小,故A正确;
B.未冷却体积偏小,浓度偏大,故B错误;
C.定容时仰视,体积偏大,浓度偏小,故C正确;
故答案为:AC;
Ⅱ.(1)步骤②加入过量H2O2将Fe2+氧化为Fe3+,所以溶液中主要存在的金属阳离子是Fe3+,
故答案为:Fe3+;
(2)由氢氧化铁悬浊液最终转化为氧化铁,需要过滤、洗涤的氢氧化铁,然后灼烧生成氧化铁,冷却后称量氧化铁的质量,
故答案为:过滤;
(3)ag氧化铁中铁元素的质量即为10片补血剂中铁的质量,所以每片补血剂含铁元素的质量:$\frac{ag×\frac{112}{160}}{10}$=0.07ag,含硫酸亚铁的质量为:$\frac{0.07a}{\frac{56}{152}}$=0.19ag,
故答案为:0.19a.
点评 本题考查学生对物质的量浓度溶液的配制实验原理与实验操作的理解、化学计算等知识,题目难度中等,清楚实验原理是解题的关键,需要学生具备扎实的基础知识与综合运用知识分析问题、解决问题的能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、Ba2+、Brˉ、CO32ˉ | B. | Clˉ、NO3ˉ、Fe2+、H+ | ||
| C. | K+、Na+、SO42ˉ、MnO4ˉ | D. | Na+、H+、SO42ˉ、HCO3ˉ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 直线形;平面三角形 | B. | V形;三角锥形 | ||
| C. | 直线形;三角锥形 | D. | V形;平面三角形 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
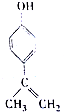
| A. | 该物质的分子式是C9H11O | |
| B. | 该物质分子中的所有C原子可以共面 | |
| C. | 滴入KMnO4(H+)溶液,可观察到紫色褪去,能证明结构中存在碳碳双键 | |
| D. | 1mol该物质分别与浓溴水和H2反应时,最多消耗Br2和H2分别是3mol、4mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该有机物不同化学环境的氢原子有8种 | |
| B. | 该有机物属于芳香族化合物 | |
| C. | 键线式中的Et代表的基团为-CH2CH3 | |
| D. | 1mol该有机物完全燃烧可以产生6mol水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
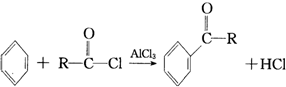
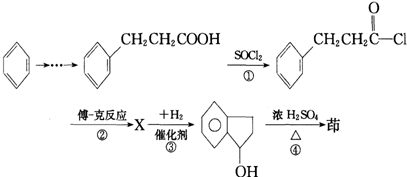
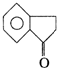
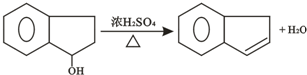
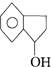 互为同分异构,满足下列三个条件:
互为同分异构,满足下列三个条件: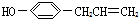
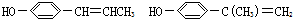 (其中两个).
(其中两个).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| Na | Ni | Al | Ti | Sn | |
| 熔点(℃) | 97.5 | 1453 | 660 | 1660 | 231.9 |
| 沸点(℃) | 883 | 2732 | 2200 | 3287 | 2270 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com