
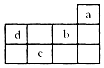
| A. | a原子最外电子层上的电子数为8 | |
| B. | b的最高价氧化物对应水化物为强酸 | |
| C. | c存在的两种常见氧化物分子组成上相差一个氧原子 | |
| D. | d和b都是第二周期的非金属元素,且d比b的非金属性强 |
分析 a、b、c、d均为短周期元素,由元素在周期表中的位置可知,a为He,b为F,c为S,d为N,
A.He原子的最外层电子数为2;
B.F无正价;
C.c存在的两种常见氧化物分别为SO3、SO2;
D.d和b都是第二周期的非金属元素,同周期从左向右非金属性增强.
解答 解:a、b、c、d均为短周期元素,由元素在周期表中的位置可知,a为He,b为F,c为S,d为N,
A.He原子只有1个电子层,最外层电子数为2,故A错误;
B.F无正价,则不存在最高价氧化物对应水化物,故B错误;
C.c存在的两种常见氧化物分别为SO3、SO2,分子组成上相差一个氧原子,故C正确;
D.d和b都是第二周期的非金属元素,同周期从左向右非金属性增强,则d比b的非金属性弱,故D错误;
故选C.
点评 本题考查位置、结构与性质,为高频考点,把握元素的位置、性质、元素周期律为解答的关键,侧重分析与应用能力的考查,注意F无正价,题目难度不大.


科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 根据物质的组成元素是否单一,将纯净物分为单质和化合物 | |
| B. | 根据反应中的能量变化,将化学反应分为氧化还原反应、非氧化还原反应 | |
| C. | 根据电解质溶液导电能力强弱,将电解质分为强电解质、弱电解质 | |
| D. | 根据变化过程中是否有化学键的断裂,将物质变化分为物理变化和化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
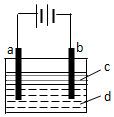 由于Fe(OH)2极易被氧化,所以实验室难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀.若用如图所示实验装置可制得纯净的Fe(OH)2沉淀.两极材料分别为石墨和铁.
由于Fe(OH)2极易被氧化,所以实验室难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀.若用如图所示实验装置可制得纯净的Fe(OH)2沉淀.两极材料分别为石墨和铁.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将30 mL 0.5 mol/L NaOH溶液加水稀释到500 mL,所得溶液的NaOH的浓度为0.3 mol/L | |
| B. | 配制250 mL 1.0 mol/L H2SO4溶液,需要18 mol/L的浓H2SO4的体积约为13.9 mL | |
| C. | 0.270 kg质量分数为10%的CuCl2溶液中Cl-的物质的量为0.2 mol | |
| D. | 80 g NaOH溶于1 L水中所得的溶液的物质的量浓度为2 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com