
| A. | 过氧化氢中既含有极性键又含有非极性键 | |
| B. | 18O原子中含有18个中子 | |
| C. | 含有相同电子数的H2O和NH3的分子数相同 | |
| D. | 苯分子中所有原子共处在同一平面上 |
分析 A、过氧化氢分子中既有极性的氢氧键,又有非极性氧氧键;
B、18O原子中的18表示质量数;
C、H2O和NH3的电子数都是10个;
D、苯分子中所有12个原子共处在同一平面上.
解答 解:A、过氧化氢分子中既有极性的氢氧键,又有非极性氧氧键,所以过氧化氢中既含有极性键又含有非极性键,故A正确;
B、18O原子中的18表示质量数,而不是中子数,故B错误;
C、H2O和NH3的电子数都是10个,所以两者有电子数相同,故C正确;
D、苯分子中所有12个原子共处在同一平面上,故D正确;
故选B.
点评 本题考查了化学键的判断、元素符号周围字母的意义和苯的结构,难度不大,明确相同原子形成的共价键是非极性共价键.


 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 杂化轨道全部参加形成化学键 | |
| B. | 杂化前后的轨道数不变,但轨道的形状发生了改变 | |
| C. | sp3、sp2、sp杂化轨道的夹角分别为109°28′、120°、180° | |
| D. | 四面体形、三角锥形的结构可以用sp3杂化轨道解释 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Cl-)=c(NH4+) | B. | NH4+水解程度增大 | ||
| C. | 氨水电离程度增大 | D. | 溶液中有少量NH4Cl存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
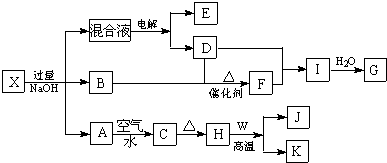
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 500 mL lmol/L Fe2(SO4)3溶液和250 mL 3 mol/L的Na2S04溶液所含硫酸根离子的浓度相等 | |
| B. | 若R的含氧酸的酸性大于Q的含氧酸的酸性,则非金属性R大于Q | |
| C. | 1.2 g NaHS04晶体中阳离子和阴离子的总数为O.03NA | |
| D. | 含NA个Na+的Na2O溶解于1 L水中,Na+的物质的量浓度为1 mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com