异烟酸与Ag(I)及硅钨酸形成的配位聚合物可用于药物嵌入等领域.
I.异烟酸制抗结核病药物异烟肼的反应为(如图1):
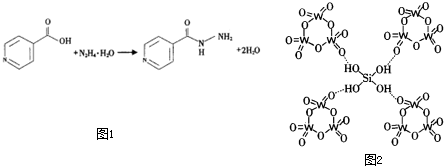
(1)异烟酸中氮原子的杂化轨道类型为
.
(2)该反应涉及第二周期元素的第一电离能从小到大的顺序为
(填元素符号).
(3)对比异烟酸和异烟肼的结构,异烟酸发生反应断裂的共价键类型主要为
.
(4)异烟肼熔点较低(173℃),且易溶于水的原因是
.
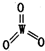
Ⅱ.硅钨酸在600℃~650℃可分解生成SiO
2和WO
2,
其结构如图2.
(5)已知钨为第六周期ⅥB族元素,其基态原子的球形轨道中共有12个电子,则钨的基态原子价电子排布式为
.
(6)根据硅钨酸的结构推测,WO
3的结构式为
.


 ,故答案为:
,故答案为: .
.

 同步练习强化拓展系列答案
同步练习强化拓展系列答案