
【题目】2SO2(g)+O2(g)![]() 2SO3(g),是工业制硫酸的主要反应之一。
2SO3(g),是工业制硫酸的主要反应之一。
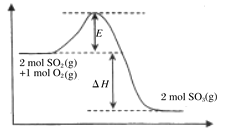
(1)该反应过程的能量变化如图所示:由图中曲线变化可知,该反应为_____(填“放热”或“吸热”)反应。该反应通常用V2O5作催化剂,加入V2O5后,改变的是图中的______。
A.ΔH B.E C. ΔH-E D. ΔH+E
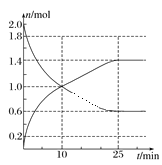
(2)在2L绝热密闭容器中投入2molSO2和bmolO2,如图是部分反应物随时间的变化曲线。
①10min时,v(SO3)=________。
②反应达到平衡时,SO2的转化率为_______。
③下列情况能说明该反应达到化学平衡的是_______。
A.v(SO3)=v(SO2)
B.混合气体的密度保持不变
C.t时刻,体系的温度不再发生改变
D.混合气体的总物质的量不再改变
【答案】放热 B 0.05mol·L-1·min-1 70% CD
【解析】
(1)由图中曲线变化可知反应物总能量高于生成物总能量,因此该反应为放热反应,该反应通常用V2O5作催化剂,加入V2O5后降低活化能,但不能改变反应热;
(2)①由图可知10min时生成三氧化硫是1mol,c(SO3)=0.5mol/L,根据v=![]() 来求反应速率,②根据物质反应转化关系计算平衡时SO2的消耗量,利用转化率定义式可得SO2的平衡转化率;
来求反应速率,②根据物质反应转化关系计算平衡时SO2的消耗量,利用转化率定义式可得SO2的平衡转化率;
③根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变判断平衡状态。
(1)由图中曲线变化可知反应物总能量高于生成物总能量,因此该反应为放热反应,该反应通常用V2O5作催化剂,加入V2O5后降低活化能,但不能改变反应物、生成物的能量,因此不能改变反应热,因此改变的是图中的E,故合理选项是B;
(2)①由图可知10min时生成SO3的物质的量是1mol,c(SO3)=1.0mol÷2L=0.5mol/L,v==![]() =0.05mol/(Lmin);
=0.05mol/(Lmin);
②反应达到平衡时生成SO3的物质的量是1.4mol,则根据方程式中物质反应转化关系可知消耗SO2的物质的量也是1.4mol,则SO2的平衡转化率为![]() ×100%=70%;
×100%=70%;
③A.v(SO3)=v(SO2),未指明是正反应速率还是逆反应速率,因此不能据此判断反应是否处于平衡状态,A错误;
B.反应在恒容密闭容器内进行,反应混合物都是气体,所以混合气体的密度始终保持不变,,不能据此反应反应是否处于平衡状态,B错误;
C.绝热密闭容器中t时刻,体系的温度不再发生改变,说明正逆反应速率相等,达平衡状态,C正确;
D.该反应是反应前后气体体积不等的反应,若混合气体的总物质的量不再改变,说明正逆反应速率相等,达平衡状态,D正确;
故合理选项是CD。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】大地震过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一,漂粉精是常用的消毒剂。
(1)工业上制取漂粉精的化学方程式为______________________,在使用漂粉精时,为了加速漂白作用,可以在漂粉精中加入少量________________.
(2)漂粉精暴露在空气中易失效的主要原因是___________、_______________(用化学方程式表示)
(3)浓盐酸和次氯酸钙能发生如下反应Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O,用贮存很久的漂粉精和浓盐酸反应制得的氯气中,可能含有的杂质气体是__________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的氢气在氯气中燃烧,所得混合物用100mL 3.00mol/L的NaOH溶液(密度为1.12g/mL)恰好完全吸收,测得溶液中含有NaClO的物质的量为0.0500mol。
(1)原NaOH溶液的质量分数为
(2)所得溶液中Cl-的物质的量为 mol
(3)所用氯气和参加反应的氢气的物质的量之比n(Cl2):n(H2)= 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在一个2L的密闭容器中,加入4molA和2molB进行如下反应:3A(g)+2B(g)![]() 4C(?)+2D(?),反应一段时间后达到平衡,测得生成1.6molC,且反应的前后压强之比为5:4(相同的温度下测量),则下列说法正确的是( )
4C(?)+2D(?),反应一段时间后达到平衡,测得生成1.6molC,且反应的前后压强之比为5:4(相同的温度下测量),则下列说法正确的是( )
A. 加压,平衡右移,化学平衡常数增大
B. 此时,B的平衡转化率是40%
C. 该反应的化学平衡常数表达式是K=![]()
D. 增加C,B的平衡转化率变小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下向10 mL 0.1 mol·L-1 NaOH溶液中加入0.1 mol·L-1的一元
酸HA,溶液pH的变化曲线如图所示。下列说法正确的是

A. a点所示溶液中c(Na+)>c(A-)>c(H+)>c(HA)
B. a、b两点所示溶液中水的电离程度相同
C. pH=7时,c(Na+)=c(A-)+c(HA)
D. b点所示溶液中c(A-)>c(HA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素A、B、C、D在元素周期表中的相对位置如表所示,已知A原子最外层电子数与次外层电子数之比为2:1。E和C、D同周期,它的原子序数比B多6。
回答下列问题:
A | B | ||
C | D |
(1)人的汗液中含有D的简单离子,其离子结构示意图为______,元素C在元素周期表中的位置是______。C的最高价氧化物的水化物的浓溶液稀释的方法是______。
(2)A的最高价氧化物的化学式为_____,所含的化学键类型是______(填“离子键”或“共价键”)。
(3)E的最高价氧化物对应的水化物的化学式为____,它是______(填“酸性”或“两性”或“碱性”)化合物。写出该化合物与氢氧化钠溶液反应的离子方程式______。
(4)加热时,B的最高价氧化物对应水合物的浓溶液与单质A反应的化学方程式为(用具体的化学式表示)______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原滴定实验与酸碱中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)。测血钙的含量时,进行如下实验:
①可将2mL血液用蒸馏水稀释后,向其中加入足量草酸铵(NH4)2C2O4晶体,反应生成 CaC2O4沉淀,将沉淀用稀硫酸处理得H2C2O4溶液。
②将①得到的H2C2O4溶液,再用酸性KMnO4溶液滴定,氧化产物为CO2,还原产物为Mn2+。
③终点时用去20mL l.0×l0﹣4 mol/L的KMnO4溶液。
(1)写出用KMn04滴定H2C2O4的离子方程式_____________________。
(2)滴定时,将KMnO4溶液装在________(填“酸式”或“碱式”)滴定管中。
(3)判断滴定终点的方法是________________________。
(4)误差分析:(填“偏高”、“偏低”或“无影响”)
①如果滴定管用蒸馏水洗后未用酸性KMnO4标准液润洗,则测量结果________。
②滴定前后读数都正确,但滴定前有气泡,而滴定后气泡消失,则测量结果________。
(5)计算:血液中含钙离子的浓度为________mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜(含有少量锌、金、银等杂质)的精炼原理,其中乙装置中X为阳离子交换膜。回答下列问题:

(1)甲烷燃料电池负极的电极反应式为_____________________。
(2)乙装置中阳离子通过X膜向________ 极(填“Fe”或“C”)移动,写出乙装置中的石墨电极上的电极方程式____________________________________。
(3)若在标况下,有2.24L氧气参与反应,则乙装置中右侧溶液________(填“增加”或“减少”)______g,丙装置中CuSO4浓度__________(填“增加”、“减少” 或“不变”);若将乙装置两侧溶液混合,常温下加水稀释至体积为4 L,则此时溶液液的pH=____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知,常温下,有氧化还原反应(未配平):HFeO4-+(NH2)2CS+H2O→Fe(OH)3+(NH2)2CO+SO42-+OH,下列有关说法正确的是
A. HFeO4-为还原剂,Fe(OH)3为氧化产物
B. 氧化剂与还原剂反应的物质的量之比为4∶3
C. 随着反应的进行,溶液中c(H+)/Kw逐渐变小
D. 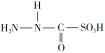 为此反应的中间产物,其中碳元素的化合价为0价
为此反应的中间产物,其中碳元素的化合价为0价
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com