
 (1)某元素原子的价电子构型为4s24p1,它属于第四周期ⅢA族,属p区元素.
(1)某元素原子的价电子构型为4s24p1,它属于第四周期ⅢA族,属p区元素.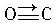 与CO结构最相似的分子是N2,这两种结构相似的分子中,分子的极性不相同(填“相同”或“不相同”).
与CO结构最相似的分子是N2,这两种结构相似的分子中,分子的极性不相同(填“相同”或“不相同”).| 晶体 | NaCl | KCl | CaO |
| 晶格能/kJ•mol-1 | 786 | 715 | 3 401 |
分析 (1)根据核外电子排布确定原子结构特点,可确定元素在周期表中的位置;
(2)磷原子核外有15个电子,运动状态各不相同;
(3)根据等电子体的结构相似来判断;由同种元素组成的双原子分子为非极性分子;由不同种元素组成的双原子分子为极性分子;
(4)晶格能越大熔点越高;根据MgO晶胞的结构,可以确定一个Mg2+周围和它最邻近且等距离的Mg2+有数目;
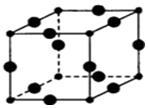
(5)晶胞中小黑色球数目为8×$\frac{1}{8}$=1,大黑色球2数目为12×$\frac{1}{4}$=3,故小黑色球为N3-、大黑色球为Cu+,补全晶胞结构可知,N3-离子周围有6个Cu+;
Cu+半径为a pm,N3-半径为b pm,则晶胞棱长为2(a+b)pm,进而计算晶胞体积、晶胞质量,再根据ρ=$\frac{m}{V}$计算晶胞密度.
解答 解:(1)某元素的原子的价电子构型为4s24p1,它在周期表中的位置是第4周期ⅢA族,属于p区元素,故答案为:四;ⅢA;p;
(2)磷原子核外有15个电子,运动状态各不相同,故答案为:15;
(3)CO与N2是等电子体,等电子体的结构相似,N2是由同种元素组成的双原子分子为非极性分子;CO是由不同种元素组成的双原子分子为极性分子,
故答案为:N2;不相同;
(4)KCl、MgO、CaO这3种晶体的结构与NaCl晶体结构相似,MgO、CaO中离子都带2个单位电荷,KCl中离子都带1个单位电荷,离子半径Cl-<O2-,Mg2+<Ca2+<K+,高价化合物的晶格能远大于低价离子化合物的晶格,晶格能MgO>CaO>KCl,故熔点MgO>CaO>KCl;在MgO晶胞中Mg2+周围有六个O2-,O2-周围有六个Mg2+,根据晶胞的结构可以看出,如果以体心上一个Mg2+为究对象,和它最邻近且等距离的Mg2+分布在晶胞每个棱边中点上,共有12个,
故答案为:MgO>CaO>KCl;12;
(5)晶胞中小黑色球数目为8×$\frac{1}{8}$=1,大黑色球2数目为12×$\frac{1}{4}$=3,故小黑色球为N3-、大黑色球为Cu+,补全晶胞结构可知,N3-离子周围有6个Cu+;
Cu+半径为a pm,N3-半径为b pm,则晶胞棱长为2(a+b)pm,晶胞体积为[2(a+b)×10-10 cm]3,晶胞质量为(64×3+14)÷NAg,则晶胞密度为[(64×3+14)÷NAg]÷[2(a+b) cm]3=$\frac{103}{4{N}_{A}(a+b)^{3}}$g•cm-3,
故答案为:6;$\frac{103}{4{N}_{A}(a+b)^{3}}$.
点评 本题考查较为综合,涉及晶胞的计算、晶体的性质以及核外电子的排布等知识,题目难度中等,明确常见晶胞结构为解答关键,注意掌握均摊法在晶胞计算中的应用,试题培养了学生的分析能力及化学计算能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 的合成路线流程图(无机试剂任选).合成路线流程图示例如下:
的合成路线流程图(无机试剂任选).合成路线流程图示例如下:查看答案和解析>>
科目:高中化学 来源: 题型:推断题
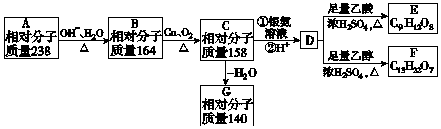
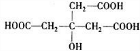 .
.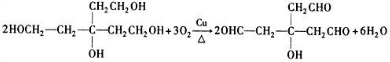 .
.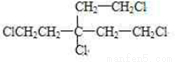 .
.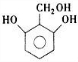 、
、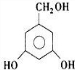 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{n}{A+16}$(A-N+8)mol | B. | $\frac{n}{A+16}$(A-N+10)mol | C. | $\frac{n}{A}$ (A-N+2)mol | D. | $\frac{n}{A}$(A-N+6)mol |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
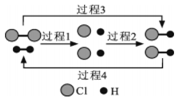 H2 能在Cl2中燃烧生成 HCl,HCl也能在一定条件下分解为H2和Cl2. 图为H2、Cl2和HCl 三者相互转化的微观过程示意图,下列属于吸热过程的是 ( )
H2 能在Cl2中燃烧生成 HCl,HCl也能在一定条件下分解为H2和Cl2. 图为H2、Cl2和HCl 三者相互转化的微观过程示意图,下列属于吸热过程的是 ( )| A. | 过程 1 | B. | 过程 2 | C. | 过程 3 | D. | 过程 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
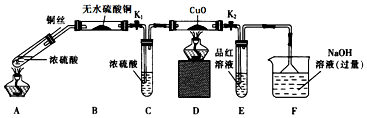
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯加到溴水中,将会和溴发生取代反应而使溴水褪色 | |
| B. | 用冷却结晶法来提纯含少量KCl杂质的KNO3晶体 | |
| C. | 将10%的葡萄糖溶液加到新制氢氧化铜悬浊液中,出现砖红色沉淀 | |
| D. | 进行淀粉水解实验时,为检验水解产物和水解程度,加液顺序为淀粉溶液→H2SO4溶液→NaOH溶液→碘水→新制Cu(OH)2悬浊液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com