
| A.金属Al无剩余 | B.c(Na+)=c(AlO-2) |
| C.生成气体为2 mol | D.c(Na+)=c(Al3+) |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①④ | B.①⑤ | C.③④ | D.①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1molCO燃烧时放出的热量为283 kJ?mol-1 |
| B.Na2O2(s)+CO(g) = Na2CO3(s)ΔH= -509 kJ?mol-1 |
| C.Na2O2(s)与CO2(g)反应放出226 kJ热量时电子转移数为2NA |
| D.Na2O2和Na2CO3中阴阳离子个数比不同 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.溴化银是重要感光材料,可用于人工降雨 |
| B.氯水用于漂白表现了HClO的强氧化性 |
| C.漂白粉的有效成分是次氯酸钙 |
| D.钠和钾的合金,可用于快中子反应堆作热交换剂 |
查看答案和解析>>
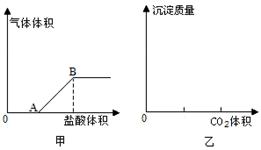
科目:高中化学 来源:不详 题型:填空题
| 实验方案 | 预测现象 | 预测依据 |
| 操作1:向2 mL Na2CO3溶液中滴加1 mL 0.5 mol·L-1CaCl2溶液 | 有白色沉淀 | Na2CO3溶液中的CO32-浓度较大,能与CaCl2发生反应Ca2+ + CO32- = CaCO3↓。 |
| 操作2:向2 mL NaHCO3溶液中滴加1 mL 0.5 mol·L-1CaCl2溶液 | 无白色沉淀 | NaHCO3溶液中的CO32-浓度很小,不能与CaCl2反应。 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Na和O2 | B.NaOH和CO2 | C.NaHCO3与盐酸 | D.MnO2与盐酸 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.只有①②③ | B.只有①③④ | C.只有②③④ | D.①②③④ |
查看答案和解析>>
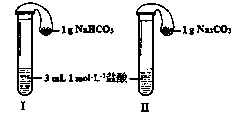
科目:高中化学 来源:不详 题型:填空题
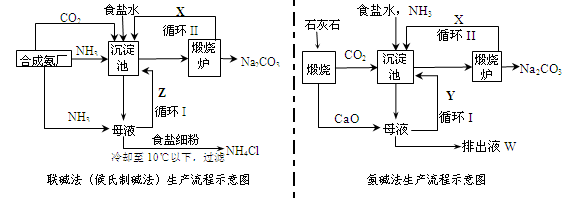
| 滴定次数 | 待测液(mL) | 0.6000mol/L盐酸溶液的体积(mL) | |
| 初读数 | 终读数 | ||
| 第一次 | 20.00 | 1.00 | 21.00 |
| 第二次 | 20.00 | 如右图Ⅰ | 如右图Ⅱ |
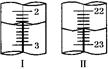 显示消耗的盐酸溶液体积为 。
显示消耗的盐酸溶液体积为 。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com