
【题目】醋酸是常见的弱酸,氨水是常见的弱碱。
(1)25℃时,用0.1000mol·L-1盐酸滴定25.00mL0.1000mol·L-1氨水的滴定曲线如图所示。
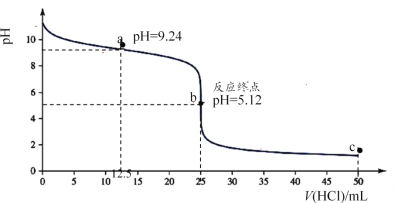
①滴定时,可选用____(填“甲基橙”或“酚酞”)作指示剂; 锥形瓶中水的电离程度:a点____b点(填“>”“<”或“=”)。
②滴定至反应终点前,溶液中发生反应的离子方程式为____。
③滴定至a点处,锥形瓶中NH4+ 、Cl-、NH3·H2O的浓度由小到大的顺序为____。
④滴定至c点处,锥形瓶中NH4+ 、Cl-、H+的浓度由小到大的顺序为____。
(2)25℃时,用HCl或NaOH调节醋酸的pH,配得一组c(CH3COOH)+c(CH3COO-)=0.1 mol·L-1溶液,溶液中H+、OH-、CH3COO-及CH3COOH浓度的对数值(lgc)与pH关系如图所示:
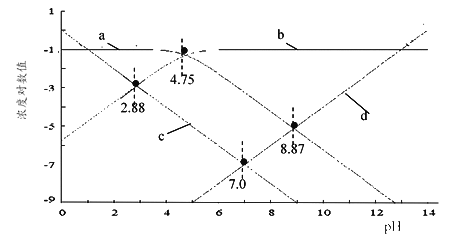
①图中表示H+的线是____(填小写字母);0.1 mol·L-1CH3COONa溶液的pH约为____(保留2位小数)。
②反应CH3COOH![]() CH3COO-+ H+的电离常数的对数值lgK=____(填数值)。
CH3COO-+ H+的电离常数的对数值lgK=____(填数值)。
【答案】 甲基橙 < NH3·H2O + H+= NH4++ H2O c(NH3·H2O) <c(Cl-) <c(NH4+) c(NH4+) <c(H+)<c(Cl-) c 8.87 -4.75
【解析】(1)①强酸滴定弱碱时滴定终点溶液呈酸性,故滴定时可选用甲基橙作指示剂;a点滴入盐酸物质的量为氨水的一半,溶液呈碱性抑制水的电离,b点达到滴定终点为氯化铵溶液,氯化铵水解促进水的电离,故锥形瓶中水的电离程度:a点<b点;②滴定至反应终点前,溶液中仍发生盐酸与氨水反应,故发生反应的离子方程式为NH3·H2O + H+= NH4++ H2O;③滴定至a点处,锥形瓶中为以按氨水和氯化铵1:1形成的溶液且溶液呈碱性,说明氨水的电离大于铵根离子的水解,故NH4+ 、Cl-、NH3·H2O的浓度由小到大的顺序为c(NH3·H2O) <c(Cl-) <c(NH4+);④滴定至c点处,锥形瓶中为以按盐酸和氯化铵1:1形成的溶液且溶液呈酸性,铵根离子的水解故离子浓度小于氯离子,锥形瓶中NH4+ 、Cl-、H+的浓度由小到大的顺序为c(NH4+) <c(H+)<c(Cl-);(2)①pH=0时lgc=0,pH=7时lgc=7,故图中表示H+的线是c;故d表示OH-的线,b表示CH3COOH的线,a表示CH3COO-的线,故0.1 mol·L-1CH3COONa溶液的pH约为8.87;②pH=4.75时,c(CH3COO-)=c(CH3COOH),K= c(H+),反应CH3COOH![]() CH3COO-+ H+的电离常数的对数值lgK=lg c(H+)=-4.75。
CH3COO-+ H+的电离常数的对数值lgK=lg c(H+)=-4.75。


 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源: 题型:
【题目】(题文)甲氧普胺(Metoclopramide)是一种消化系统促动力药.它的工业合成路线如下[已知氨基(-NH2)易被氧化剂氧化]:
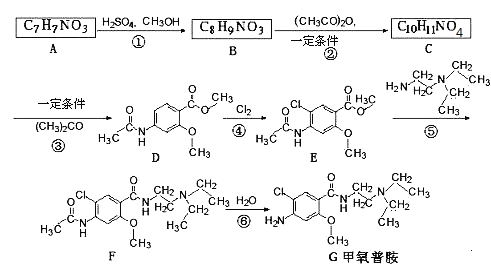
请回答下列问题:
(1)下列说法中不正确的是 (_______)
A、化合物A能形成内盐 B、1molB最多能与2molNaOH反应
C、D的分子式为C11H13NO3 D、甲氧普胺属于芳香族化合物
(2)化合物C的结构简式:_______________________________________
(3)写出D→E的化学方程式:______________________________________________________
(4)写出符合下列要求的化合物A(C7H7NO3)的可能的同分异构体 _________________________
①属于芳香族化合物,能发生银镜反应 ②能发生水解 ③苯环上的一氯取代物只有两种
(5)写出以甲苯为原料合成对氨基苯甲酸:![]() ,模仿以下流程图设计合成路线,标明每一步的反应物及反应条件_________。(有机物写结构简式,其它无机试剂自选)
,模仿以下流程图设计合成路线,标明每一步的反应物及反应条件_________。(有机物写结构简式,其它无机试剂自选)
已知:Ⅰ、当一取代苯进行取代反应时,使新取代基进入它的邻、对位的取代基:-CH3、-NH2;使新取代基进入它的间位的取代基:-COOH、-NO2;
Ⅱ、-NH2易被氧化;-NO2可被Fe和HCl还原成-NH2。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取一小块金属钠,放在燃烧匙里加热,下列实验现象描述正确的是( )
①金属钠熔化
②在空气中燃烧,放出黄色火花
③燃烧后得到白色固体
④燃烧时火焰为黄色
⑤燃烧后生成淡黄色固体物质
A.①②⑤B.①②③C.①④⑤D.④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在Al2(SO4)3和MgSO4的混合溶液中,滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液的体积关系如右图所示,则原混合液中Al2(SO4)3与MgSO4的物质的量浓度之比为( )

A. 6:1 B. 3:1 C. 2:1 D. 1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镉(Cd)是一种用途广泛的金属,也是对人体健康威胁最大的有害元素之一。
(1)1.00gCdS固体完全燃烧生成CdO固体和SO2气体放出2.75kJ的热量,该反应的热化学方程式为____。
(2)常温下,Ksp(CdCO3) = 4.0×10-12,Ksp[Cd(OH)2] = 3.2 ×10-14,则溶解度(mol·L-1)较大的是____ [填“CdCO3”或“Cd(OH)2”];若向含112mg·L-1 Cd2+的废水加碱调pH至9.0,达到平衡时,溶液中c(Cd2+)=____。
(3)一种鳌合絮凝剂的制备及其用于去除含镉废水中Cd2+的原理如下:

①聚丙酰胺的单体的结构简式为____。
②使用鳌合絮凝剂处理某含镉废水,镉去除率与pH的关系如图-1所示。在强酸性条件下,pH越小除镉效果越差,其原因是____。

(4)一种用电动力学修复被镉污染的土壤的装置如图-2所示。
①实验前铁粉需依次用NaOH溶液、稀硫酸及蒸馏水洗涤,其目的是____。
②实验过程中铁粉上发生的电极反应为____。
③活性炭的作用是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相等物质的量的KClO3分别发生下述反应:①有MnO2催化剂存在时,受热分解得到氧气; ②若不使用催化剂,加热至470 ℃左右,得到KClO4(高氯酸钾)和KCl。下列关于①和②的说法不正确的是
A. 都是氧化还原反应 B. 发生还原反应的元素相同
C. 发生氧化反应的元素不同 D. 生成KCl的物质的量相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A. 0.1mol SiO2晶体中含有Si-O键的数目为0.2NA
B. 56g铁粉与高温水蒸气反应,生成H2数目为1.5NA
C. 标准状况下,22.4 LCl2溶于水,转移电子数为NA
D. 18gH218O和2H2O的混合物中,所含中子数为9NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com