
【题目】C、Be、Cl、Fe等元素及其化合物有重要的应用。
(1)查表得知,Be的电负性是1.5,Cl的电负性是3.0,则BeCl2应为 (填离子或共价)化合物;根据铍元素和铝元素在周期表中的位置,推测BeCl2应与 (填MgCl2或AlCl3)化学性质更相似。
(2)上述四种元素的原子中,未成对电子数最多的元素是_________________。
(3)①试根据原子核外电子排布所遵循的原理解释Fe2+具有较的强还原性,易被氧化为Fe3+的原因 。②当然Fe3+也有氧化性,在印刷行业中就用氯化铁溶液腐蚀铜板,写出离子方程式 。
(4)一定条件下,C元素可形成多种晶体。下图1是其中某种晶体的一个晶胞,该晶胞中含有________个C原子。
(5)下图2为金属铁某种晶体的晶胞结构,已知铁的摩尔质量是56gmol-1,该晶体的密度为a gcm-3,NA为阿伏加德罗常数的值,则该晶胞的体积为_________cm3。
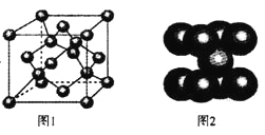
【答案】(1)共价,AlCl3(2)Fe(3)具有较的强还原性,易被氧化为Fe3+①Fe2+的外围电子排布为3d6,当失去一个电子后变成3d5的半充满结构的Fe3+,较稳定②2Fe3+ +Cu =2Fe2++Cu2+(4)8 (5)112/aNA
【解析】
试题分析:(1)Be的电负性是1.5,Cl的电负性是3.0,3.0-1.5=1.5,电负性的差值小于1.7,所以BeCl2应为共价化合物;铍元素和铝元素在周期表中位于对角线的位置,性质相似,所以BeCl2与AlCl3化学性质更相似。
(2)C、Be、Cl、Fe四种元素中,未成对电子数分别为2、0、1、4,最多的元素是铁。
(3)①Fe2+的外围电子排布为3d6,当失去一个电子后变成3d5的半充满结构的Fe3+,Fe2+较稳定。
②氯化铁与铜反应生成氯化亚铁和氯化铜,反应的离子方程式为2Fe3++Cu=2Fe2++Cu2+。
(4)利用均摊法计算C原子数,8×1/8+6×1/2+4=8,则该晶胞中含有8个碳原子。
(5)由图2可知,该晶胞为体心立方晶胞,一个晶胞中含有铁原子个数为8×1/8+1=2,则该晶胞的体积为V=(2×56)÷(NA×a)=112/aNA。


科目:高中化学 来源: 题型:
【题目】化学与社会、生活密切相关,下列有关说法中不正确的是
A.硅胶多孔,常用作食品干燥剂
B.氨易液化,常用作制冷剂
C.飞机播撒AgI是实现人工降雨的一种方法
D.为了防止蛋白质盐析,疫苗等生物制剂应冷冻保藏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟在自然界中常以CaF2的形式存在。
(1)下列关于CaF2的表述正确的是_____。
a.Ca2+ 与F﹣间仅存在静电吸引作用
b.F﹣的离子半径小于Cl﹣,则CaF2的熔点高于CaCl2
c.阴阳离子比为2∶1的物质,均与CaF2晶体构型相同
d.CaF2中的化学键为离子键,因此CaF2在熔融状态下能导电
(2)CaF2难溶于水,但可溶于含Al3+的溶液中,原因是 _____________________(用离子方程式表示)。
(3)F2通入稀NaOH溶液中可生成OF2,OF2分子构型为_____,其中氧原子的杂化方式为____。
(4)F2与其他卤素单质反应可以形成卤素互化物,例如ClF3、BrF3等。已知反应Cl2(g)+3F2(g)═2ClF3(g)△H=﹣313kJmol﹣1,F﹣F键能159kJmol﹣1,Cl﹣Cl键的键能为242kJmol﹣1,则ClF3中Cl﹣F键的平均键能为________ kJmol﹣1,ClF3的熔、沸点比BrF3的_____(填“高”或“低”)。
(5)如图为CaF2、H3BO3(层状结构,层内的H3BO3分子通过氢键结合)、金属铜三种晶体的结构示意图,请回答下列问题:
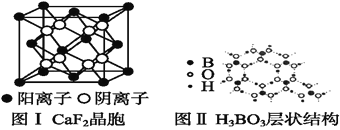
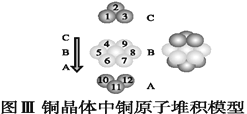
①图Ⅰ所示的CaF2晶胞中与Ca2+最近且等距离的F-数为____,图Ⅲ中未标号的铜原子形成晶体后周围最紧邻的铜原子数为____。
②图Ⅱ所示的物质结构中最外层已达8电子结构的原子是____。H3BO3晶体中B原子个数与极性键个数比为____。
③三种晶体中熔点最低的是____,其晶体受热熔化时,克服的微粒之间的相互作用力为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于1L H2SO4和HNO3的混合溶液,若H2SO4和HNO3物质的量浓度存在如下关系:c(H2SO4)+c(HNO3)=1.2mol/L,则理论上最多能溶解铜的物质的量为
A. 0.40mol B. 0.45mol C. 0.72mol D. 0.80mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分。
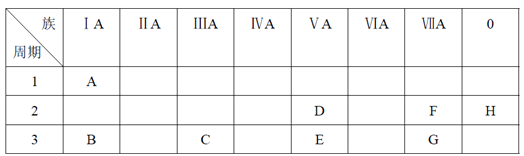
根据A~G元素在周期表中的位置,用化学式填写空白。
(1)氧化性最强的单质是______,还原性最强的单质是______,化学性质最不活泼的单质是______。(填相应的化学式)
(2)最稳定的氢化物是______。(填相应的化学式)
(3)一个E原子的核外电子总共有______种运动状态。
(4)按碱性逐渐减弱、酸性逐渐增强的顺序,将B、C、E、G四种元素的最高价氧化物对应水化物的化学式排列成序是_______。(填相应的化学式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设 NA为阿伏加德罗常数的值。下列说法正确的是
A. 3.2g 由氧气和臭氧组成的混合物中含有氧原子的数目为 0.3NA
B. 0.1 molL-1 的 FeCl3 溶液中 Cl-的数目为 0.3NA
C. 标准状况下,11.2L 水中含有原子的数目为 1.5NA
D. 1 mol Cl2 与足量的铁反应转移的电子数目是 2 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:X(g)+2Y(g)![]() 3Z(g) △H=-akJ·mol-1(a>0),下列说法不正确的是
3Z(g) △H=-akJ·mol-1(a>0),下列说法不正确的是
A. 0.1molX和0.2molY充分反应生成Z的物质的量一定小于0.3mol
B. 达到化学平衡状态时,X、Y、Z的浓度不再发生变化
C. 达到化学平衡状态时,反应放出的总热量可达a Kj
D. 升高反应温度,逆反应速率增大,正反应速率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知氨可以与灼热的氧化铜反应得到氮气、金属铜和一种氧化物。用下图装置可以实现该反应。

回答下列问题:
(1)A 中发生反应的化学方程式是_____;
(2)B 中加入的物质是____;
(3)实验时在 C 中观察到的现象是______, 发生反应的化学方程式是_______;
(4)实验时在 D 中观察到的现象是出现无色液体,D 中收集到的物质是____,检验该 物质的方法和现象是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴苯是不溶于水的液体,常温下不与酸、碱反应,可用如图装置制取(该反应放出热量)。制取时观察到锥形瓶中导管口有白雾出现等现象。下列说法错误的是
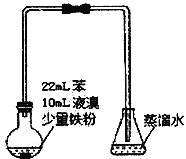
A. 制备溴苯的反应属于取代反应
B. 该反应过程中还可能看到烧瓶中有红色蒸汽
C. 装置图中长直玻璃导管仅起导气作用
D. 溴苯中溶有少量的溴,可用NaOH溶液洗涤除去
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com