
【题目】下列离子方程式书写正确的是
A. 苯酚钠溶液中通入少量氧化碳:2C6H5O- +CO2+H2O![]() 2C6H5OH+CO32-
2C6H5OH+CO32-
B. 苯酚与氢氧化钠溶液反应:C6H5OH +OH-![]() C6H5O-+H2O
C6H5O-+H2O
C. 醋酸和碳酸钠溶液反应:CO32-+2H+=CO2↑+H2O
D. 向CH2BrCOOH中加入足量的氢氧化钠溶液并加热:CH2BrCOOH+OH-![]() CH2BrCOO-+H2O
CH2BrCOO-+H2O
科目:高中化学 来源: 题型:
【题目】KClO3和浓盐酸在一定温度下发生如(1)的反应:
(1)请配平方程式,并用双线桥表示得失电子情况: KClO3+HCl(浓)=KCl+ClO2↑+Cl2↑+H2O
(2)氧化剂是 , 还原产物是(写化学式).
(3)产生0.1molCl2时,转移电子的物质的量为mol.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)
① 欲使蛋白质从水溶液中析出而又不改变它的主要性质,应加入________(填字母)。
a. 福尔马林 b. 饱和硫酸钠溶液 c. 硫酸铜溶液
② 鉴别苯和甲苯的方法或试剂是________(填字母)。
a. 浓溴水 b. 酸化的KMnO4溶液 c. 在空气中点燃
③ 下列化合物中,常温常压呈液态的是________(填字母)。
a. 甲醇 b. 乙炔 c. 丙烯
(2) 制备聚酯玻璃钢需要下列四种物质:
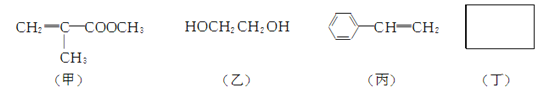
① 甲中不含氧原子的官能团是________(填名称)。
② 淀粉通过下列转化可以得到乙(其中A~D均为有机物):
 A的化学式是________,C→D的反应类型是________。
A的化学式是________,C→D的反应类型是________。
③ 丙发生加聚反应的生成物为________(写结构简式)。
④ 化合物丁仅含碳、氢、氧三种元素,相对分子质量为110。丁与FeCl3溶液作用显紫色,且丁分子中烃基上的一氯取代物只有一种。则丁的结构简式为________。
(3) A~F的转化关系如下(已知A分子中无甲基):
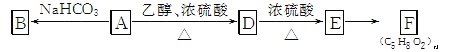
① 有机物A的相对分子质量为90,9 g A和足量Na反应,生成2.24 L H2(标准状况),则A的分子式为________。
② A缩聚生成高分子化合物的结构简式为________。
③ 由E生成F的反应类型是________。
④ 由D生成E的化学方程式为________。
⑤ 写出与A具有相同官能团的A的同分异构体的结构简式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于气体摩尔体积的几种说法正确的是( )
A.22.4L任何气体的物质的量均为1mol
B.非标准状况下,1mol任何气体不可能占有22.4L体积
C.0.4molH2、0.2molO2、和0.4molCO2组成的混合气体,在标准状况下约为22.4L
D.同温、同压下,相同质量的CO和CO2具有相同的体积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列十种物质:①H2 ②铝 ③CuO ④CO2 ⑤H2SO4 ⑥Ba(OH)2 ⑦红褐色的氢氧化铁液体 ⑧氨水 ⑨稀硝酸⑩Al2(SO4)3
(1)按物质的分类方法填写表格的空白处:
分类标准 | 氧化物 | 电解质 | |||
属于该类的物质 | ② | ⑧⑨ | ⑦ |
(2)写出 ⑥⑨的化学反应方程式 .
(3)⑩在水中的电离方程式为 , 17.1g⑩溶于水配成250mL溶液,SO42﹣的粒子数为 , SO42﹣的物质的量浓度为 .
(4)少量的④通入⑥的溶液中反应的化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将6.4gSO2和8.0gSO3相比较,下列结论中错误的是( )
A.它们的体积之比为1:1
B.它们所含氧原子数目之比为2:3
C.它们的分子数目之比为1:1
D.它们所含原子数目之比为3:4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究NO2、SO2、CO等大气污染气体的处理及利用的方法具有重要意义。
(1)①已如:2SO2(g)+O2(g)2SO3(g) △H=-196.6kJmol-1
2NO(g)+O2(g)2NO2(g) △H=-113.0kJmol-1
请写出NO2与SO2反应生成SO3(g)和NO的热化学力程 式_________________________。
②一定条件下,将NO2与SO2以体积比1:2置于2L密闭容器中发生上述反应,下列能说明反应达到平衡状态的是__________。(填字母序号)
a.体系压强保持不变 b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变 d.每消耗1molSO2的同时生成1mlINO2
(2)①工 业上一般以CO和H2为原料合成甲醇。该反应的热化学方程式为:CO(g)+2H2(B)![]() CH3OH(g)△H=-99kJmol-1。则反应物的总能量__________(填高于、低于或者等于)生成物的总能量。
CH3OH(g)△H=-99kJmol-1。则反应物的总能量__________(填高于、低于或者等于)生成物的总能量。
②在恒温条件下体积为2L的密闭容器中,将1mol CO与3molH2的混合气体在催化剂作用下发生反应生成甲醇。2min时制得生成CH3OH0.2mol,则0~2min的平均反应速率v(H2)=_________。CO 的转化率为_______。反应前后的压强比为____________。
③恒温恒容时,改变下列条件能加快以上反应的速率的是__________(填字母序号)。
a.充入情性气体 b.增加CO的量 C.升高温度 d.减小H2的量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肉桂酸甲酯G是治疗白癜风的重要药物,也是一种用于调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精。它的分子式为C10H10O2, 用芳香烃A为原料合成肉桂酸甲酯G的路线如下:
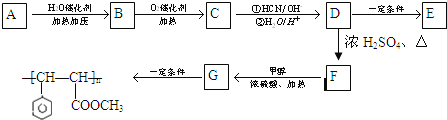
已知![]()
试回答下列问题:
(1)肉桂酸甲酯G的结构简式为___________________。
(2)A的名称为________,C中含有的官能团名称为_________。
(3)D→F的反应类型是________反应。
(4)写出B→C的化学方程式:_________________。
(5)E 为聚酯,则D转化为E 的化学方程式是_______________。
(6)对于D,下列说法正确的是____________。(填字母序号)
A.1mol D最多可以可2molNaOH反应
B.在催化剂作用下,1mol该物质与足量氢气充分反应,最多可消耗4molH2
C .可生成含有三个六元环的酯
D.可 与 NaHCO3 溶液反应放出CO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com