

| A. | 流程中的反应全部都是非氧化还原反应 | |
| B. | M是盐酸 | |
| C. | 电解熔融MgO比电解熔融MgCl2制金属镁更节约能量 | |
| D. | 操作b只是过滤 |
分析 生石灰和水反应生成石灰乳,将海水引入沉淀池中,氢氧化钙和镁离子反应生成氢氧化镁沉淀,反应离子方程式为Mg2++Ca(OH)2═Mg(OH)2+Ca2+,然后采用过滤方法分离难溶性氢氧化镁和溶液,所以操作a是过滤;得到的Mg(OH)2固体溶于稀盐酸得到MgCl2溶液,所以试剂M是稀盐酸,发生反应方程式为Mg(OH)2+2HCl=MgCl2+2H2O,将氯化镁溶液蒸发浓缩、冷却结晶得到MgCl2晶体,将MgCl2晶体在HCl氛围中加热得到无水MgCl2,电解熔融氯化镁得到Mg,据此分析解答.
解答 解:生石灰和水反应生成石灰乳,将海水引入沉淀池中,氢氧化钙和镁离子反应生成氢氧化镁沉淀,反应离子方程式为Mg2++Ca(OH)2═Mg(OH)2+Ca2+,然后采用过滤方法分离难溶性氢氧化镁和溶液,所以操作a是过滤;得到的Mg(OH)2固体溶于稀盐酸得到MgCl2溶液,所以试剂M是稀盐酸,发生反应方程式为Mg(OH)2+2HCl=MgCl2+2H2O,将氯化镁溶液蒸发浓缩、冷却结晶、过滤得到MgCl2晶体,将MgCl2晶体在HCl氛围中加热得到无水MgCl2,电解熔融MgCl2得到Mg,
A.电解熔融MgCl2时,Mg元素化合价由+2价变为0价、Cl元素化合价由-1价变为0价,所以有电子转移,属于氧化还原反应,故A错误;
B.通过以上分析知,M是稀盐酸,故B正确;
C.MgO熔沸点比MgCl2高,如果电解熔融MgO冶炼Mg会造成能源浪费,故C错误;
D.通过以上分析知,b是蒸发浓缩、冷却结晶、过滤等操作,故D错误;
故选B.
点评 本题以海水资源的综合利用为载体考查镁的制取,明确流程中发生的反应及操作方法是解本题关键,注意从氯化镁晶体获取无水氯化镁时需要在HCl氛围中加热,因为氯化镁易水解.


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:解答题
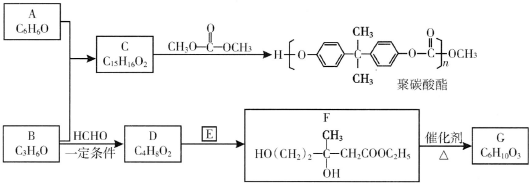
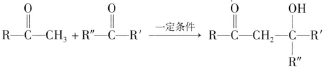 (R、R′、R″为氢原子或烃基)
(R、R′、R″为氢原子或烃基) ,E的分子式是C4H8O2,F生成G的反应类型是取代反应?
,E的分子式是C4H8O2,F生成G的反应类型是取代反应? .G的同分异构体有多种,其中和G具有完全相同环状结构的同分异构体有23种(不包含G,不考虑立体异构).
.G的同分异构体有多种,其中和G具有完全相同环状结构的同分异构体有23种(不包含G,不考虑立体异构).查看答案和解析>>
科目:高中化学 来源: 题型:填空题
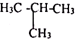 C、${\;}_{6}^{12}$C和${\;}_{6}^{14}$C D、甲烷和丙烷.
C、${\;}_{6}^{12}$C和${\;}_{6}^{14}$C D、甲烷和丙烷.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y一定是氯元素 | |
| B. | R一定是离子化合物 | |
| C. | R中每个原子都达到了8个电子的稳定结构 | |
| D. | 常温下,R可能是液态物质,也可能是固态物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用CuSO4溶液将ZnS转化成CuS沉淀:S2-+Cu2+═CuS↓ | |
| B. | NH4HCO3溶液与过量NaOH溶液混合加热:NH${\;}_{4}^{+}$+OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| C. | 向酸化的FeSO4溶液中滴入少量H2O2溶液:H2O2+2Fe2++2H+═2Fe3++2H2O | |
| D. | 用惰性电极电解饱和的KCl溶液:2H++2Cl$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca(HCO3)2 | B. | Na2SiO3 | C. | FeCl2 | D. | AlCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 改进汽车尾气净化技术,减少大气污染物的排放 | |
| B. | 开发利用可再生能源,减少化石燃料的使用 | |
| C. | 过度开采矿物资源,促进地方经济发展 | |
| D. | 研发可降解高分子材料,减少“白色污染” |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用量筒量取所需浓硫酸时,仰视刻度线 | |
| B. | 将量筒中的浓硫酸倒入烧杯后,没有用水冲洗量筒2-3次并转移至烧杯中 | |
| C. | 用胶头滴管滴加蒸馏水定容时,仰视刻度线 | |
| D. | 定容摇匀后,液面下降,没有重新加蒸馏水至刻度线 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com