
| A. | c(H+)=0.1 mol•L-1的溶液:Na+、NH4+、SO42-、S2O32- | |
| B. | pH=0的透明溶液中,Na+、Fe3+、MnO4-、NO3- | |
| C. | 稀溴水中:H+、Na+、SO42-、葡萄糖分子 | |
| D. | 0.1mol•L-1的NH4HCO3溶液中:Ca2+、K+、S2-、Br- |
分析 A.硫代硫酸根离子与氢离子发生反应;
B.pH=0的溶液中存在大量氢离子,四种离子之间不反应,都不与氢离子反应;
C.溴水具有强氧化性,能够氧化葡萄糖;
D.钙离子与硫离子反应生成硫化钙沉淀.
解答 解:A.S2O32-与溶液中氢离子反应,在溶液中不能大量共存,故A错误;
B.pH=0的溶液为酸性溶液,溶液中存在大量氢离子,Na+、Fe3+、MnO4-、NO3-之间不反应,都不与氢离子反应,在溶液中能够大量共存,故B正确;
C.葡萄糖分子中含有醛基,稀溴水具有强氧化性,二者发生氧化还原反应,在溶液中不能大量共存,故C错误;
D.Ca2+、S2-之间反应生成硫化钙,在溶液中不能大量共存,故D错误;
故选B.
点评 本题考查离子共存,为高频考点,题目难度中等,把握习题中的信息及常见离子之间的反应条件为解答的关键,侧重复分解反应、氧化还原反应的离子共存考查,试题培养了学生灵活应用基础知识的能力.


科目:高中化学 来源: 题型:选择题
| A. | 沸点HBr>HCl,则同族元素氢化物沸点HCl>HF | |
| B. | Fe3O4可表示为FeO•Fe2O3,则Pb3O4可表示为PbO•Pb2O3 | |
| C. | CO2与Na2O2反应只生成Na2CO3和O2,故SO2与Na2O2反应也只生成Na2SO3和O2 | |
| D. | SiO2能形成原子晶体,一定条件下CO2也能形成原子晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
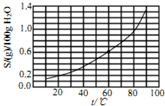
| A. | 25℃时,溴酸银微溶于水 | |
| B. | 溴酸银溶解度随温度升高而增大 | |
| C. | 60℃时溴酸银的Kap约等于2.5×10-4 | |
| D. | 往溴酸银浊液中滴加NaI有黄色固体生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分液时,水溶液一定从下口放出 | |
| B. | 蒸馏时,如果温度计水银球下端高于蒸馏烧瓶支管口上沿,收集到的馏分沸点偏高 | |
| C. | 滴定时,左手控制滴定管活塞,右手握持锥形瓶,边滴边振荡,眼睛注视滴定管中的液面 | |
| D. | 量取20.0mL浓硫酸时,俯视读数,所取液体体积偏大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知,A是常见的金属单质,与B的水溶液反应生成C和D.D、F是气体单质,D在F中燃烧时产生苍白色火焰.A、B、C、D、E、F六种物质的相互转化关系如图所示(反应条件及部分产物未列出)
已知,A是常见的金属单质,与B的水溶液反应生成C和D.D、F是气体单质,D在F中燃烧时产生苍白色火焰.A、B、C、D、E、F六种物质的相互转化关系如图所示(反应条件及部分产物未列出)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2FeC12+C12=2FeC13 | B. | Fe+CuSO4=Cu+FeSO4 | ||
| C. | C12+2NaOH=NaC1+NaC1O+H2O | D. | 2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
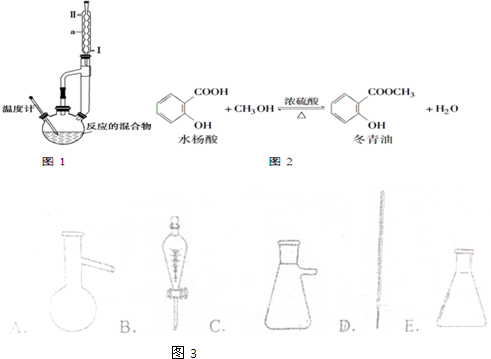
| 相对分 子质量 | 密度/g•cm-3 | 沸点/℃ | 溶解性 | |
| 冬青油 | 152 | 1.180 | 222.2 | 微溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 改变外界条件使化学平衡状态改变时,平衡常数也一定改变 | |
| B. | 改变条件,反应物的转化率增大,平衡常数一定增大 | |
| C. | 若一个可逆反应的平衡常数很大,则反应会在较短的时间内完成 | |
| D. | 已知2NO2?N2O4正反应的平衡常数为K1,逆反应的平衡常数为K2,则K1=$\frac{1}{{K}_{2}}$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com