
(1)达到平衡后混合气的平均分子量
(2)A的转化率
(3)B的系数![]() 的值
的值
(4)相同条件下反应前A气体的密度是平衡混合气密度的多少倍?
 导学教程高中新课标系列答案
导学教程高中新课标系列答案科目:高中化学 来源: 题型:阅读理解
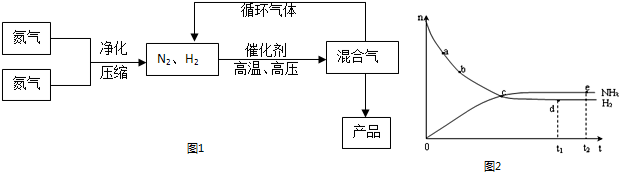
| 气体 | 氮气 | 氢气 | 氨 |
| 熔点(℃) | -210.01 | -252.77 | -77.74 |
| 沸点(℃) | -195.79 | -259.23 | -33.42 |
查看答案和解析>>
科目:高中化学 来源: 题型:038
在673K,1.01![]() 帕下,有1摩某气体A,发生如下反应:2A(气)
帕下,有1摩某气体A,发生如下反应:2A(气)![]()
![]() B(气)+ C(气)并达到平衡,A在平衡混合气中的体积百分含量为58.6%,混合气的总质量为46 g,密度为0.72 g
B(气)+ C(气)并达到平衡,A在平衡混合气中的体积百分含量为58.6%,混合气的总质量为46 g,密度为0.72 g![]() 。求:
。求:
(1)达到平衡后混合气的平均分子量
(2)A的转化率
(3)B的系数![]() 的值
的值
(4)相同条件下反应前A气体的密度是平衡混合气密度的多少倍?
查看答案和解析>>
科目:高中化学 来源: 题型:
在673K,1.01×105帕下,有1mol某气体A,发生如下反
![]()
中的体积百分含量为58.6%,混合气的总质量为46g,密度为0.72g·L-1。求:
(1)达到平衡后混合气的平均分子量
(2)A的转化率
(3)B的系数x的值
(4)相同条件下反应前A气体的密度是平衡混合气密度的多少倍?
查看答案和解析>>
科目:高中化学 来源:同步题 题型:计算题
 xB(气)+C(气)。在一定条件下已达到平衡。在平衡混合气体中,A占其体积百分比为58.84%。混合气体总质量为46g,密度为0.72g·L-1。求
xB(气)+C(气)。在一定条件下已达到平衡。在平衡混合气体中,A占其体积百分比为58.84%。混合气体总质量为46g,密度为0.72g·L-1。求查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com