
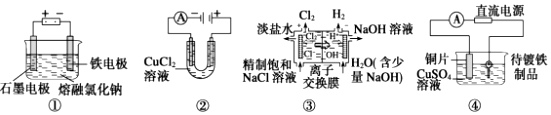
| A. | 装置①工业上可用于生产金属钠,电解过程中石墨电极产生金属 | |
| B. | 装置②中阳极产生的气体可以使湿润的淀粉碘化钾试纸变蓝 | |
| C. | 装置③中的离子交换膜允许阳离子、阴离子和小分子水通过 | |
| D. | 装置④的待镀铁制品应与电源正极相连 |
分析 A.电解池中阴极上金属离子放电生成单质;
B.氯离子在阳极失电子;
C.离子交换膜只允许离子和分子通过,而图中应是阳离子交换膜,所以只允许阳离子和水分子通过;
D.电镀池中,镀层作电解池阳极,待镀金属作阴极.
解答 解:A.装置①中阴极上金属离子放电生成单质,即金属单质在铁电极上生成,故A错误;
B.装置②中氯离子在阳极失电子,生成氯气,氯气能使湿润的淀粉碘化钾试纸变蓝,故B正确;
C.离子交换膜只允许离子和分子通过,而图中应是阳离子交换膜,所以只允许阳离子和水分子通过,而不允许阴离子氢氧根离子通,故C错误;
D.装置③中,电镀池中,镀层作电解池阳极,待镀金属作阴极,则待镀铁制品应与电源负极相连,故D错误;
故选B.
点评 本题考查原电池和电解池原理,根据电极上得失电子及离子放电顺序来分析解答,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 标准状况下1molSO3的体积约为22.4L | |
| B. | pH小于7的雨水被称为酸雨 | |
| C. | 同温同压下,等质量的N2O4和NO2两种气体体积比为1:2 | |
| D. | 同温同压下,等质量的O2和SO2的所含原子个数比为1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;当温度过高时,尾气中有毒气体的含量会升高,原因是CO2+C$\frac{\underline{\;高温\;}}{\;}$2CO(用化学方程式表示).
;当温度过高时,尾气中有毒气体的含量会升高,原因是CO2+C$\frac{\underline{\;高温\;}}{\;}$2CO(用化学方程式表示).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 取样,加少量AgNO3溶液,有白色沉淀;再加稀硝酸,看白色沉淀是否消失 | |
| B. | 取样,先加盐酸酸化,再加入AgNO3溶液,看是否有白色沉淀生成 | |
| C. | 取样,先加稀硫酸酸化,再加入AgNO3溶液,看是否有白色沉淀生成 | |
| D. | 取样,滴加AgNO3溶液,看是否有白色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | X、Y均能燃烧,都有大量浓烟产生 | |
| B. | X既能使酸性高锰酸钾溶液褪色,也能使溴水褪色,还能发生加聚反应 | |
| C. | X属于苯的同系物 | |
| D. | Y的二氯代物有2种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向某溶液中先滴加氯水,再滴加KSCN溶滚,溶液显血红色,说明原溶液中含有Fe3+ | |
| B. | 向某溶液中滴加过量氨水,先有白色沉淀产生,然后沉淀溶解,说明原溶液中含有Al3+ | |
| C. | 向某溶液中滴加Ca(OH)2溶液,得到白色沉淀,说明原溶液中含有CO32- | |
| D. | 向某溶液中滴加过量NaOH溶液,得到蓝色沉淀,说明原溶液中含有Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水的电离程度始终增大 | |
| B. | $\frac{c(N{{H}_{4}}^{+})}{c(N{H}_{3}•{H}_{2}O)}$先增大再减小 | |
| C. | 当加入氨水的体积为10mL时,c(NH4+)=c(CH3COO-),c(H+)=c(OH-) | |
| D. | 当加入氨水的体积为10mL时,溶液中的pH=7,由水电离出的c(H+)=1×10-7 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y、Z、W一定同周期 | B. | 简单氢化物稳定性:X>Z | ||
| C. | X、Y组成的化合物具有两性 | D. | 离子半径大小:Z>W>Y>X |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com