
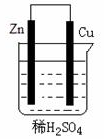
| A. | 将电能转换为化学能 | B. | 电子由铜片流出 | ||
| C. | 锌片时负极 | D. | 铜片逐渐被腐蚀 |
 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案科目:高中化学 来源: 题型:选择题
| 时间/s | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
| A. | 0~20 s内,v(NO2)=0.005 mol•L-1•s-1 | |
| B. | 59 s时,c(NO2)一定大于0.12 mol•L-1 | |
| C. | 若仅将起始时充入NO2的量增至0.80 mol,则该反应的平衡常数K>$\frac{25}{9}$ | |
| D. | 若上述反应在120℃时进行,则反应至80 s时,n(N2O4)<0.08 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不慎将酸溅到眼中,应立即用水冲洗,边洗边眨眼睛 | |
| B. | 不慎将浓碱沾到皮肤上,应立即用大量水冲洗,然后涂上硼酸溶液 | |
| C. | 稀释浓硫酸时,将浓硫酸沿器壁慢慢注入水中,并不断搅拌 | |
| D. | 实验室中酒精燃烧,小面积着火,立即用水扑灭 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 28 g氮气含有的原子数为NA | |
| B. | 4g金属钙的物质的量为1mol | |
| C. | 1 mol O2分子的质量等于1 mol氧原子的质量 | |
| D. | 24 g O2分子和24 g O3分子所含的氧原子数目相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质量数为78 | B. | 质子数为53 | C. | 核外电子数为131 | D. | 中子数为53 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 92.3% | B. | 75% | C. | 66.75% | D. | 不能确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
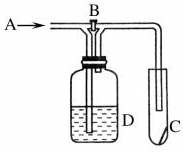 如图是一种试验某气体化学性质的实验装置,图中B为开关.若先打开B,在A处通入干燥的氯气,C中红色布条颜色无变化;当关闭B在A处通入干燥的氯气时,C中红色布条颜色褪去.则D瓶中盛有的溶液是( )
如图是一种试验某气体化学性质的实验装置,图中B为开关.若先打开B,在A处通入干燥的氯气,C中红色布条颜色无变化;当关闭B在A处通入干燥的氯气时,C中红色布条颜色褪去.则D瓶中盛有的溶液是( )| A. | 浓NaI溶液 | B. | 浓NaOH溶液 | C. | 饱和NaCl溶液 | D. | 浓硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
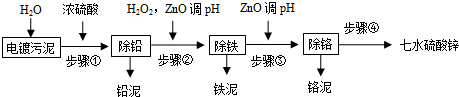
| 离子 | Fe2+ | Fe3+ | Cr3+ | Zn2+ |
| 开始沉淀的pH值 | 5.9 | 2.3 | 3.9 | 5.7 |
| 完全沉淀的pH值 | 8.3 | 3.2 | 5.6 | 8.3 |
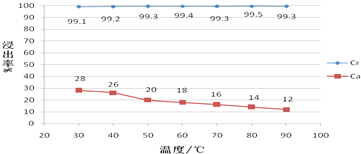
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| T(℃) | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com